
Tóm tắt
Nội dung bài
New Page 1
I. BÁO CÁO ADR TỪ CÁC CƠ SỞ KHÁM, CHỮA BỆNH
1. Số lượng báo cáo đã tiếp nhận
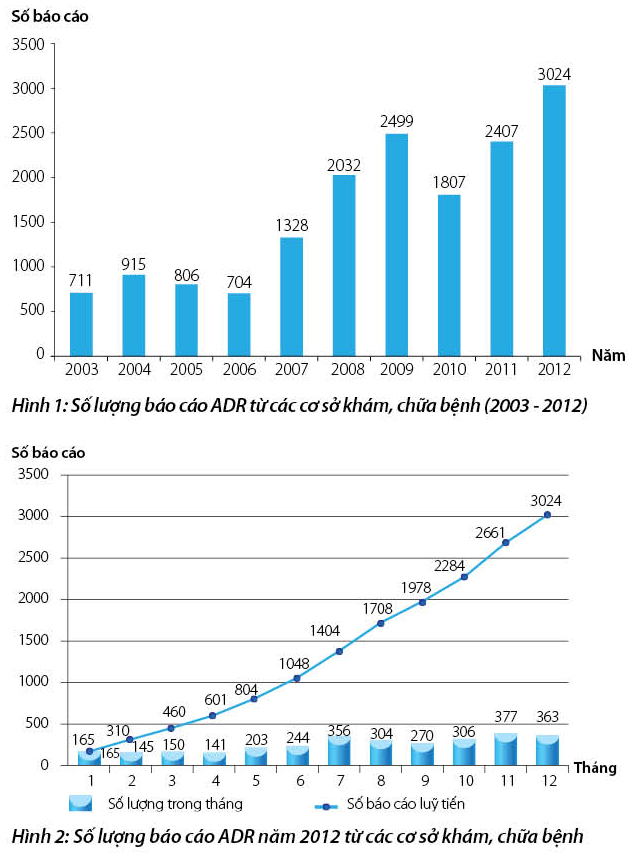
Số lượng báo cáo tiếp nhận được năm 2012 (3024 báo cáo) (hình 1) tăng đáng kể (25,6%) so với năm 2011. Nhìn chung, báo cáo ADR nhận được phân bố tương đối đều trong các tháng nhưng tập trung nhiều hơn vào các tháng cuối năm (hình 2).
2. Tình hình báo cáo ADR từ các đơn vị
364 cơ sở khám chữa bệnh của 61/63 tỉnh, thành phố đã tham gia gửi báo cáo ADR. Hai tỉnh chưa gửi báo cáo ADR đến thời điểm cuối năm (15/12/2013) là Bắc Kạn và Thừa Thiên Huế. Mười đơn vị có số lượng báo cáo ADR nhiều nhất được liệt kê trong bảng 1.
3. Các thuốc nghi ngờ gây ra ADR được báo cáo nhiều nhất
Số lượng thuốc nghi ngờ gây ADR trong 3024 báo cáo ADR là 3679 thuốc (tỷ lệ 1,22 thuốc/1 báo cáo). Các thuốc nghi ngờ gây ADR xuất hiện nhiều nhất thuộc 3 nhóm chính: kháng sinh (cefotaxim, ceftriaxon, cefalexin, ceftazidim, ciprofloxacin), thuốc điều trị lao (streptomycin, pyrazinamid, rifampicin) và thuốc giảm đau, hạ sốt, chống viêm (paracetamol và diclofenac). Trong đó, cefotaxim là thuốc nghi ngờ gây ADR được báo cáo nhiều nhất (12,1%) (bảng 2).
4. Các trường hợp báo cáo khẩn
Trong năm 2012, Trung tâm DI&ADR Quốc gia đã xử lý 20 trường hợp báo cáo ADR khẩn, chủ yếu là sốc phản vệ đe dọa tính mạng người bệnh. Số ca tử vong là 10 trường hợp, trong đó 5 trường hợp liên quan đến thuốc cản quang có chứa iod. Trung tâm cũng xử lý 9 chuỗi báo cáo, trong đó ADR xảy ra với cùng một hoạt chất trên 1 hoặc nhiều lô sản phẩm (bảng 3).
5. Kết quả thẩm định và phản hồi báo cáo ADR
Đến hết tháng 12/2012, 665 báo cáo nhận được đã được thẩm định và phản hồi cho người báo cáo (61 báo cáo khẩn và 604 báo cáo nghiêm trọng). Mối quan hệ nhân quả giữa thuốc và ADR được các chuyên gia thẩm định theo thang của Tổ chức Y tế Thế giới. Trong đó, số ADR ở 3 mức độ cao nhất (chắc chắn, có khả năng và có thể) chiếm 98,1% tổng số ADR được thẩm định. Các ADR được báo cáo chủ yếu là các ADR nhẹ, hồi phục không có di chứng (72,0%). Có 12 báo cáo liên quan đến ADR nghiêm trọng gây tử vong (1,9%).
|
Bảng 1: Danh sách 10 bệnh viện gửi báo cáo nhiều nhất năm 2012 |
|||
|
STT |
Đơn vị gửi báo cáo |
Tỉnh/thành phố |
Số lượng báo cáo |
|
1 |
Bệnh viện Phạm Ngọc Thạch |
TP. Hồ Chí Minh |
204 |
|
2 |
Bệnh viện Đa khoa tỉnh Quảng Ninh |
Quảng Ninh |
111 |
|
3 |
Bệnh viện Đà Nẵng |
Đà Nẵng |
84 |
|
4 |
Bệnh viện Phụ Sản Trung Ương |
Hà Nội |
83 |
|
5 |
Bệnh viện Từ Dũ |
TP. Hồ Chí Minh |
81 |
|
6 |
Bệnh viện Nhân Dân Gia Định |
TP. Hồ Chí Minh |
66 |
|
7 |
Bệnh viện Đa khoa TP. Cần Thơ |
Cần Thơ |
60 |
|
8 |
Bệnh viện Lao và Bệnh Phổi Bắc Giang |
Bắc Giang |
59 |
|
9 |
Bệnh viện Chợ Rẫy |
TP. Hồ Chí Minh |
52 |
|
10 |
Bệnh viện Phụ Sản - Nhi Đà Nẵng |
Đà Nẵng |
48 |
|
Bảng 3: Các trường hợp báo cáo khẩn |
|||||
|
STT |
Số báo cáo |
Thuốc nghi ngờ |
ADR |
Mối liên quan giữa thuốc và ADR |
Kết quả sau khi xử trí ADR |
|
1 |
1 |
Carbosin (carboplatin) |
Sốc phản vệ |
Chắc chắn |
Hồi phục không để lại di chứng |
|
2 |
1 |
Carbosin (carboplatin) |
Sốc phản vệ |
Chắc chắn |
Hồi phục không để lại di chứng |
|
3 |
1 |
Esmeron (rocuronium) |
Sốc phản vệ |
Có khả năng |
Tử vong |
|
4 |
1 |
Fentanyl Propofol Suxamethonium Pipecuronium |
Sốc phản vệ |
Có khả năng |
Tử vong |
|
5 |
1 |
Xenetic (iobitridol) |
Sốc phản vệ |
Chắc chắn |
Tử vong |
|
6 |
3 |
Relab 20% (albumin) |
Rét run, khó thở |
Có khả năng |
Không có thông tin |
|
7 |
3 |
Xenetic (iobitridol) |
Sốc phản vệ |
Chắc chắn |
1 trường hợp tử vong, 2 trường hợp hồi phục không để lại di chứng |
|
8 |
1 |
Xenetic (iobitridol) |
Sốc phản vệ |
Chắc chắn |
Tử vong |
|
9 |
1 |
Iopamiro (iopamidol) |
Phản ứng phản vệ |
Chắc chắn |
Tử vong |
|
10 |
3 |
Relab 20% (albumin) |
Phản ứng phản vệ |
Chắc chắn |
Hồi phục không để lại di chứng |
|
11 |
1 |
Alpha Kiisin (alphachymotrypsin) |
Sốc phản vệ |
Có khả năng |
Tử vong |
|
12 |
5 |
Koceam (cefotaxim) |
Buồn nôn, mẩn ngứa toàn thân |
Chắc chắn |
Hồi phục không để lại di chứng |
|
13 |
6 |
Rabi-kit (rabeprazol, clarithromycin, ornidazol) |
Mệt mỏi, lơ mơ, bủn rủn, đau đầu, chóng mặt |
Chắc chắn |
Hồi phục không để lại di chứng |
|
14 |
1 |
Telebrix (acid ioxitalamic) |
Sốc phản vệ |
Chắc chắn |
Tử vong |
|
15 |
13 |
Relab 20% (albumin) |
Phản ứng phản vệ |
Chắc chắn |
Hồi phục không để lại di chứng hoặc thiếu thông tin |
|
16 |
10 |
Kepain (ketoprofen) |
Phản ứng phản vệ hoặc phản ứng dị ứng nhẹ |
Chắc chắn |
Hồi phục không để lại di chứng hoặc thiếu thông tin |
|
17 |
3 |
Cefotaxim |
Mẩn đỏ, ngứa, mày đay, khó thở |
Chắc chắn |
Hồi phục không để lại di chứng hoặc thiếu thông tin |
|
18 |
1 |
Zidovudin |
Thiếu máu nghiêm trọng, giảm bạch cầu, giảm tiểu cầu |
Có khả năng |
Tử vong |
|
19 |
4 |
Ketorola (ketorolac) |
Sưng mắt, sưng môi, mẩn đỏ, mày đay |
Chắc chắn |
Hồi phục không để lại di chứng |
|
20 |
1 |
Isofluran Suxamethonium
|
Sốt cao, mạch nhanh, loạn nhịp tim sau đó mạch chậm, huyết áp tụt, ngừng tim, tử vong |
Có khả năng |
Tử vong |
|
Bảng 4: Danh sách các thuốc nghi ngờ được báo cáo nhiều nhất từ các đơn vị sản xuất và kinh doanh dược phẩm |
|||
|
STT |
Tên hoạt chất |
Tần số |
Tần suất (%) |
|
1 |
Imatinib |
106 |
47,96 |
|
2 |
Vắc xin* |
25 |
11,31 |
|
3 |
Thuốc bổ sung calci |
9 |
4,07 |
|
4 |
Zoledronat |
9 |
4,07 |
|
5 |
Sorafenib |
6 |
2,71 |
|
6 |
Azithromycin |
4 |
1,81 |
|
7 |
Các vitamin và chất khoáng |
4 |
1,81 |
|
8 |
Ampicilin/sulbactam |
3 |
1,36 |
|
9 |
Iopromid |
3 |
1,36 |
|
10 |
Paracetamol |
3 |
1,36 |
|
11 |
Propofol |
3 |
1,36 |
|
12 |
Vildagliptin |
3 |
1,36 |
* Trong đó, 18 báo cáo liên quan đến vắc xin Quinvaxem.
II. BÁO CÁO ADR TỪ CÁC ĐƠN VỊ SẢN XUẤT VÀ KINH DOANH DƯỢC PHẨM
15 đơn vị sản xuất và kinh doanh dược phẩm đã gửi báo cáo ADR nghiêm trọng xảy ra trên lãnh thổ Việt Nam hoặc tại các nước khác với các sản phẩm đang có số đăng ký và lưu hành tại Việt Nam về Trung tâm Quốc gia và Trung tâm khu vực về Thông tin thuốc và Theo dõi phản ứng có hại của thuốc trong năm 2012.
Số trường hợp tử vong nghi ngờ do thuốc xảy ra ở Việt Nam được báo cáo là 21 trường hợp. Trong đó, 14 trường hợp tử vong xảy ra vào các năm 2010, 2011 và 2012 liên quan đến việc sử dụng vắc xin Quinvaxem.
Danh sách các thuốc nghi ngờ gây ADR xảy ra nhiều nhất được trình bày trong bảng 4.
III. KẾT LUẬN
Công tác báo cáo ADR năm 2012 đã có chuyển biến đáng kể so với năm 2011 với số lượng báo cáo thu nhận được là cao nhất từ khi hoạt động báo cáo ADR được triển khai tại Việt Nam. Tuy nhiên, số lượng này vẫn còn rất thấp so với số lượng ADR xảy ra trong thực hành tại các cơ sở khám, chữa bệnh kèm theo chất lượng thông tin của nhiều báo cáo còn chưa cao. Thực tế này cho thấy cần tăng cường tập huấn nâng cao nhận thức và hướng dẫn kỹ năng phát hiện, theo dõi và báo cáo ADR cho cán bộ y tế. Việc hoàn thiện các quy trình chuyên môn hướng dẫn báo cáo, tạo nhiều kênh báo cáo ADR, công tác thẩm định, phản hồi thông tin cho người báo cáo cũng cần được đẩy mạnh. Trung tâm DI&ADR Quốc gia và Trung tâm khu vực về DI&ADR
TP. Hồ Chí Minh chân thành cảm ơn sự hợp tác của các đơn vị và cán bộ y tế đã gửi báo cáo ADR trong năm 2012 và mong muốn tiếp tục nhận được sự hợp tác, hỗ trợ từ các đơn vị trong công tác Cảnh giác dược và đảm bảo an toàn thuốc tại Việt Nam.

