
Nội dung bài
I. BÁO CÁO ADR TỪ CÁC CƠ SỞ ĐIỀU TRỊ
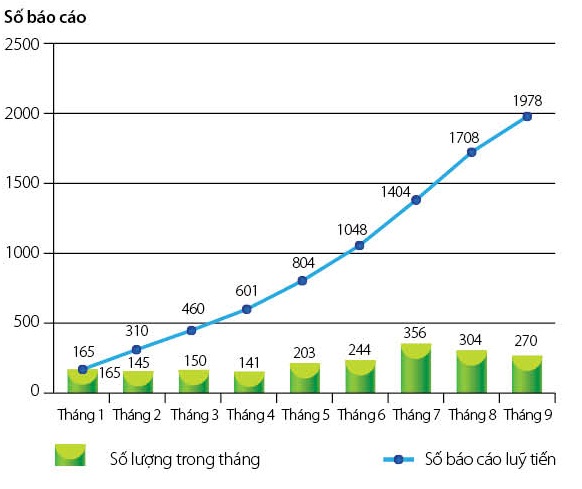
1. Số lượng báo cáo đã thu nhận
Tổng số báo cáo ADR nhận được đến hết quý III năm 2012 từ các cơ sở điều trị thuộc các tỉnh thành trong cả nước là 1978 báo cáo. So với 6 tháng đầu năm (1048 báo cáo), số lượng báo cáo ADR đã tăng gần gấp đôi. Chi tiết số lượng báo cáo ADR lũy kế nhận được từ tháng 1
đến hết tháng 9 năm 2012 được trình bày trong hình 1.
2. Tình hình gửi báo cáo ADR
Tính đến hết quý III năm 2012, có 60/63 tỉnh thành đã gửi báo cáo ADR.
Ba tỉnh chưa có báo cáo ADR là Bắc Kạn; Đắc Nông; Thừa Thiên Huế. 10 cơ sở khám chữa bệnh gửi nhiều báo cáo ADR nhất trong tổng số 288 đơn vị đã gửi báo ADR cáo được liệt kê trong bảng 1.
|
Bảng 1: Danh sách 10 bệnh viện gửi báo cáo ADR nhiều nhất |
|||
|
STT |
Bệnh viện |
Tỉnh/Thành phố |
Số lượng báo cáo |
|
1 |
Bệnh viện Phạm Ngọc Thạch |
TP. Hồ Chí Minh |
156 |
|
2 |
Bệnh viện Đa khoa Tỉnh Quảng Ninh |
Quảng Ninh |
63 |
|
3 |
Bệnh viện Phụ sản Trung ương |
Hà Nội |
54 |
|
4 |
Bệnh viện Nhân Dân Gia Định |
TP. Hồ Chí Minh |
51 |
|
5 |
Bệnh viện Đà Nẵng |
Đà Nẵng |
50 |
|
6 |
Bệnh viện Từ Dũ |
TP. Hồ Chí Minh |
47 |
|
7 |
Bệnh viện Nhi Đồng II |
TP. Hồ Chí Minh |
46 |
|
8 |
Bệnh viện Da Liễu TP. Hồ Chí Minh |
TP. Hồ Chí Minh |
42 |
|
9 |
Bệnh viện Đa khoa Thị Xã Tân Châu |
An Giang |
39 |
|
10 |
Bệnh viện Chợ Rẫy |
TP. Hồ Chí Minh |
37 |
3. Các thuốc nghi ngờ gây ra ADR được báo cáo nhiều nhất
Có tổng số 2388 thuốc nghi ngờ được ghi nhận từ 1978 báo cáo ADR (tỷ lệ 1,2 thuốc/1 báo cáo). Trong đó, các thuốc nghi ngờ gây biến cố bất lợi xuất hiện nhiều nhất vẫn thuộc 3 nhóm chính: kháng sinh (cefotaxim, ceftriaxon, ceftazidim, cefuroxim); thuốc điều trị lao (streptomycin, pyrazinamid, rifampicin); và thuốc giảm đau, hạ sốt, chống viêm (paracetamol và diclofenac) (bảng 2). Cefotaxim là thuốc nghi ngờ được báo cáo nhiều nhất (10,3%).
|
Bảng 2: Các thuốc nghi ngờ gây ADR đượcbáo cáo nhiều nhất |
|||
|
STT |
Hoạt chất |
Tần suất |
Tỷ lệ (%) |
|
1 |
Cefotaxim |
246 |
10,3 |
|
2 |
Streptomycin |
177 |
7,4 |
|
3 |
Ceftriaxon |
125 |
5,2 |
|
4 |
Paracetamol |
86 |
3,6 |
|
5 |
Ceftazidim |
78 |
3,3 |
|
6 |
Diclofenac |
78 |
3,3 |
|
7 |
Pyrazinamid |
63 |
2,6 |
|
8 |
Rifampicin |
63 |
2,6 |
|
9 |
Ciprofloxacin |
59 |
2,5 |
|
10 |
Cefuroxim |
54 |
2,3 |
4. Các trường hợp báo cáo khẩn
Trong quý III năm 2012, Trung tâm DI&ADR Quốc gia đã giải quyết 8 trường hợp báo cáo khẩn, chủ yếu là sốc phản vệ, trong đó có 4 trường hợp tử vong (2 trường hợp liên quan đến thuốc cản quang Xenetic (iobitridol)).
|
Bảng 3: Các trường hợp báo cáo khẩn |
|||||
|
Số TT |
Mã báo cáo tại trung tâm DI&ADR |
Thuốc nghi ngờ |
Phản ứng có hại |
Mối liên quan giữa thuốc |
Kết quả sau khi xử trí ADR |
|
1 |
VNMN12061024 |
Fentanyl Propofol Suxamethonium Pipecuronium |
Sốc phản vệ |
Có khả năng |
Tử vong |
|
2 |
VNMS12061043 |
Xenetic (iobitridol) |
Sốc phản vệ |
Chắc chắn |
Tử vong |
|
3 |
VNMN12071230 |
Relab 20% (albumin) |
Rét run |
Có khả năng |
Không có thông tin |
|
VNMN12071231 |
Rét run, khó thở |
||||
|
VNMN12071232 |
Rét run, khó thở |
||||
|
4 |
VNMS12060867 |
Xenetic (iobitridol) |
Sốc phản vệ |
Chắc chắn |
Chưa hồi phục |
|
VNMS12060931 |
Sốc phản vệ |
Tử vong |
|||
|
VNMS12060932 |
Phản ứng phản vệ |
Hồi phục không để lại di chứng |
|||
|
5 |
VNMS12071322 |
Iopamiro (iopamidol) |
Phản ứng phản vệ |
Chắc chắn |
Tử vong |
|
6 |
VNMN12071254 |
Relab 20% (albumin) |
Phản ứng phản vệ |
Có mối quan hệ |
Hồi phục không để lại di chứng |
|
VNMN12071255 |
|||||
|
VNMN12071256 |
|||||
|
7 |
VNMN12071368 |
Alpha Kiisin (alphachymotrypsin) |
Sốc phản vệ |
Có khả năng |
Tử vong |
|
8 |
VNMN12081579 VNMN12081580 VNMN12081581 VNMN12081582 VNMN12081583 |
Koceam (cefotaxim) dùng đường tĩnh mạch |
Buồn nôn, |
Chắc chắn |
Hồi phục không để lại di chứng |
II. BÁO CÁO ADR TỪ CÁC ĐƠN VỊ SẢN XUẤT VÀ KINH DOANH DƯỢC PHẨM
Trong 9 tháng đầu năm 2012, tổng cộng có 13 đơn vị sản xuất và kinh doanh dược phẩm đã gửi báo cáo ADR nghiêm trọng xảy ra trên lãnh thổ Việt Nam và tại các nước có lưu hành sản phẩm đang có số đăng ký lưu hành tại Việt Nam cho Trung tâm DI&ADR Quốc gia và Trung tâm DI&ADR khu vực Thành phố Hồ Chí Minh.
Danh sách 13 đơn vị đã gửi báo cáo bao gồm:
1. VPĐD Janssen-Cilag Việt Nam (22 báo cáo);
2. VPĐD Novartis Pharma Services AG (71 báo cáo);
3. RO Bayer South East Asia Vietnam (10 báo cáo);
4. VPĐD Boehringer Ingelheim Việt Nam (7 báo cáo);
5. VPĐD Merk Sharp & Dohme (Asia) Ltd Việt Nam (3 báo cáo);
6. CTCP Y Dược VP Pharma (32 báo cáo);
7. Công ty Merck KgaA Việt Nam (1 báo cáo);
8. CTCP Interdist (2 báo cáo);
9. Công ty TNHH Sanofi Aventis Việt Nam (9 báo cáo);
10. VPĐD công ty Pfizer (6 báo cáo);
11. Công ty B. Braun Melsungen AG (26 báo cáo);
12. Công ty Dược phẩm Trung Ương 1 (2 báo cáo);
13. VPĐD GlaxoSmithKline Pte Ltd (1 báo cáo).
Tổng số lượng báo cáo ADR nghiêm trọng từ các đơn vị sản xuất và kinh doanh dược phẩm là 192 báo cáo. Trong đó, 134 báo cáo ADR nghiêm trọng xảy ra trên lãnh thổ Việt Nam, 58 báo cáo nghiêm trọng xảy ra tại nước ngoài với 19 trường hợp tử vong (14 ca tử vong xảy ra trên lãnh thổ Việt Nam).
III. BÁO CÁO HOẠT ĐỘNG GIÁM SÁT CHỦ ĐỘNG PHẢN ỨNG CÓ HẠI CỦA THUỐC KHÁNG RETROVIRUS (ARV)
Sau 9 tháng tuyển chọn bệnh nhân và 3 tháng tiếp tục theo dõi, hoạt động giám sát chủ động phản ứng có hại của thuốc ARV đã thu được những kết quả bước đầu. Tỷ lệ bệnh nhân xảy ra biến cố bất lợi trên nhóm bệnh nhân mới bắt đầu sử dụng thuốc ARV là 21%. Tỷ lệ bệnh nhân mới gặp biến cố bất lợi trên nhóm bệnh nhân cũ (bệnh nhân chuyển đổi phác đồ từ d4T sang AZT hoặc TDF và từ AZT sang TDF) là 67,6%. Trong đó, đã ghi nhận được biến cố bất lợi do phác đồ sử dụng trước khi chọn vào chương trình giám sát chủ động trên 219 bệnh nhân. Số liệu tổng hợp được tổng kết trong bảng 4.
|
Bảng 4: Tổng hợp số lượng bệnh nhân gặp biến cố bất lợi và số lượng biến cố bất lợi |
|||
|
|
Bệnh nhân mới |
Bệnh nhân cũ |
Tổng |
|
Tổng số bệnh nhân theo dõi |
665 |
367 |
1032 |
|
Số biến cố bất lợi |
221 |
374 |
595 |
|
Số bệnh nhân gặp biến cố bất lợi |
140 |
248 |
388 |
|
Tỷ lệ bệnh nhân gặp biến cố bất lợi |
21% |
67,6% |
37,6% |
Tổng số biến cố bất lợi ghi nhận được là 595 biến cố (trung bình 1,5 biến cố bất lợi/1 bệnh nhân). Trong đó, 221 biến cố bất lợi xuất hiện trên 140 bệnh nhân mới chủ yếu là các biến cố nhẹ như phát ban, chóng mặt, nhức đầu, ngứa, nôn, buồn nôn, thiếu máu, vàng da… 374 biến cố bất lợi xuất hiện trên 248 bệnh nhân cũ chủ yếu là các biến có có hại nghiêm trọng hơn: rối loạn phân bố mỡ, thiếu máu, tê bì, nhiễm độc gan,… Chi tiết một số biến cố bất lợi xuất hiện với tỷ lệ > 1% được tổng kết trong bảng 5 và bảng 6.
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
KẾT LUẬN
Trong 3 quý đầu năm 2012, Trung tâm DI & ADR Quốc gia đã tiếp nhận 1978 báo cáo từ 288 cơ sở điều trị, 192 báo cáo ADR nghiêm trọng từ 13 đơn vị sản xuất, kinh doanh dược phẩm. Đối tượng tham gia báo cáo chủ yếu là bác sĩ, phần lớn báo cáo được gửi từ các đơn vị ở phía Nam, từ các bệnh viện tuyến tỉnh, bệnh viện đa khoa và bệnh viện thuộc khối công lập.
Hoạt động giám sát chủ động ADR của thuốc ARV đã ghi nhận được 388 trường hợp gặp biến cố bất lợi trong tổng số 1032 bệnh nhân được giám sát trong 9 tháng tuyển chọn và 3 tháng theo dõi (chiếm 37,6%).

