
Nội dung bài
I. BÁO CÁO ADR TỪ CÁC CƠ SỞ ĐIỀU TRỊ
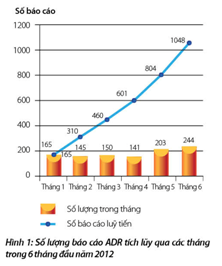
1. Số lượng báo cáo đã thu nhận
Tổng số báo cáo ADR nhận được trong 6 tháng đầu năm 2012 từ các đơn vị y tế trong cả nước là 1048 báo cáo. So với 6 tháng đầu năm 2011 (649 báo cáo), số lượng báo cáo ADR đã tăng đáng kể. Số lượng báo cáo ADR nhận được duy trì đều qua các tháng đầu năm và có xu hướng tăng nhẹ vào tháng 5 và tháng 6. Chi tiết số lượng báo cáo đã nhận được lũy tiến qua các tháng trong 6 tháng đầu năm 2012 được trình bày trong hình 1.
2. Tình hình gửi báo cáo ADR
Trong 6 tháng đầu năm 2012, có 56/64 tỉnh thành đã gửi báo cáo ADR. 8 tỉnh chưa nhận được báo cáo ADR là Bắc Kạn; Đắc Nông; Ninh Bình; Phú Yên; Sơn La; Tây Ninh; Thừa Thiên Huế; Vĩnh Phúc. 10 cơ sở khám chữa bệnh gửi nhiều báo cáo nhất trong tổng số 212 đơn vị đã gửi báo cáo được liệt kê trong bảng 1.
|
Bảng 1: Danh sách 10 bệnh viện gửi báo cáo nhiều nhất |
|||
|
STT |
Bệnh viện |
Tỉnh/Thành phố |
Số báo cáo |
|
1 |
Bệnh viện Phạm Ngọc Thạch |
TP. Hồ Chí Minh |
107 |
|
2 |
Bệnh viện đa khoa Tỉnh Quảng Ninh |
Quảng Ninh |
63 |
|
3 |
Bệnh viện Nhân Dân Gia Định |
TP. Hồ Chí Minh |
31 |
|
4 |
Bệnh viện Từ Dũ |
TP. Hồ Chí Minh |
30 |
|
5 |
Bệnh viện đa khoa TP. Cần Thơ |
Cần Thơ |
29 |
|
6 |
Bệnh viện Phụ Sản Hải Phòng |
Hải Phòng |
26 |
|
7 |
Bệnh viện đa khoa Thị Xã Tân Châu |
An Giang |
21 |
|
8 |
Bệnh viện đa khoa Đồng Nai |
Đồng Nai |
20 |
|
9 |
Bệnh viện Đà Nẵng |
Đà Nẵng |
18 |
|
10 |
Bệnh viện đa khoa Huyện An Phú |
An Giang |
17 |
|
Bảng 2: Các thuốc nghi ngờ gây ADR được báo cáo nhiều nhất |
|||
|
STT |
Hoạt chất |
Tần suất |
Tỷ lệ (%) |
|
1 |
Cefotaxim |
134 |
11,0 |
|
2 |
Streptomycin |
97 |
8,0 |
|
3 |
Ceftriaxon |
64 |
5,3 |
|
4 |
Paracetamol |
58 |
4,8 |
|
5 |
Ceftazidim |
49 |
4,0 |
|
6 |
Diclofenac |
49 |
4,0 |
|
7 |
Rifampicin |
42 |
3,4 |
|
8 |
Pyrazinamid |
34 |
2,8 |
|
9 |
Amoxicilin |
29 |
2,4 |
|
10 |
Ciprofloxacin |
27 |
2,2 |
3. Các thuốc nghi ngờ gây ra ADR được báo cáo nhiều nhất
Có tổng số 1219 thuốc nghi ngờ được báo cáo từ 1043 báo cáo ADR (tỷ lệ 1,17 thuốc/
1 báo cáo). Trong đó, các thuốc nghi ngờ gây biến cố có hại xuất hiện nhiều nhất trong các báo cáo ADR thuộc 3 nhóm chính: kháng sinh betalactam (cefotaxim, ceftriaxon, ceftazidim, amoxicilin); thuốc điều trị lao (streptomycin, pyrazynamid, rifampicin); và thuốc giảm đau, hạ sốt, chống viêm (paracetamol và diclofenac). Cefotaxim là thuốc được báo cáo nhiều nhất với tỷ lệ là 11%.
II. BÁO CÁO ADR TỪ CÁC ĐƠN VỊ SẢN XUẤT VÀ KINH DOANH DƯỢC PHẨM
Trong 6 tháng đầu năm 2012, tổng cộng có 11 đơn vị sản xuất và kinh doanh dược phẩm đã gửi báo cáo ADR nghiêm trọng xảy ra trên lãnh thổ Việt Nam và tại các nước khác có lưu hành sản phẩm đang có số đăng ký và sử dụng tại Việt Nam cho Trung tâm DI&ADR Quốc gia. Danh sách 11 đơn vị đã gửi báo cáo bao gồm: 1. VPĐD Janssen-Cilag Việt Nam (6 báo cáo);
2. VPĐD Novartis Pharma Services AG (41 báo cáo); 3. RO Bayer South East Asia Vietnam (4 báo cáo); 4. VPĐD Boehringer Ingelheim Việt Nam
(4 báo cáo); 5. VPĐD Merk Sharp & Dohme (Asia) Ltd Việt Nam (1 báo cáo); 6. CTCP Y Dược VP Pharma (12 báo cáo); 7. Công ty Merck KgaA Việt Nam (1 báo cáo); 8. CTCP Interdist (1 báo cáo); 9. Công ty TNHH Sanofi Aventis Việt Nam (3 báo cáo); 10. VPĐD Pfizer (5 báo cáo); 11. B. Braun Melsungen AG (6 báo cáo).
Tổng số lượng báo cáo ADR nghiêm trọng từ các đơn vị sản xuất và kinh doanh dược phẩm là 84 báo cáo. Trong đó, 66 báo cáo ADR nghiêm trọng xảy ra trên lãnh thổ Việt Nam (6 ca tử vong xảy ra trên lãnh thổ Việt Nam), 18 báo cáo nghiêm trọng xảy ra tại nước ngoài (1 trường hợp tử vong).
III. TÌNH HÌNH TRIỂN KHAI HOẠT ĐỘNG GIÁM SÁT CHỦ ĐỘNG PHẢN ỨNG CÓ HẠI CỦA THUỐC KHÁNG VIRUS HIV TẠI 5 CƠ SỞ TRỌNG ĐIỂM ĐIỀU TRỊ HIV/AIDS
Bắt đầu triển khai từ tháng 10/2011, sau 9 tháng hoạt động, cho đến nay chương trình đã tuyển chọn được đủ số bệnh nhân dự kiến là 665 bệnh nhân mới bắt đầu sử dụng thuốc kháng virus HIV (thuốc ARV) và 367 bệnh nhân cũ (bệnh nhân được chuyển đổi phác đồ từ d4T sang AZT hoặc TDF và từ AZT sang TDF). Trong tổng số 367 bệnh nhân cũ chuyển đổi phác đồ được lựa chọn, 219 bệnh nhân chuyển đổi phác đồ là do phản ứng có hại của thuốc (chiếm 59,7%). Kết thúc thời gian tuyển chọn bệnh nhân, các bệnh nhân tiếp tục được theo dõi trong vòng 12 tháng (kể từ sau khi được chọn vào chương trình) để ghi nhận thông tin lâm sàng và phát hiện các phản ứng có hại của thuốc kháng virus HIV.
|
Bảng 3: Các cơ sở trọng điểm điều trị HIV/AIDS trong Hoạt động Giám sát chủ động. Phản ứng có hại của thuốc ARV và thông tin về số lượng bệnh nhân |
||||
|
STT |
Tên cơ sở trọng điểm |
Số bệnh nhân mới |
Số bệnh nhân cũ |
Tổng số bệnh nhân |
|
1 |
Bệnh viện Đa khoa Đống Đa |
113 |
34 |
147 |
|
2 |
Bệnh viện 09 |
87 |
60 |
147 |
|
3 |
Trung tâm phòng chống HIV/AIDS tỉnh Hải Dương |
75 |
67 |
142 |
|
4 |
Trung tâm y tế dự phòng Quận Bình Thạnh |
141 |
181 |
322 |
|
5 |
Bệnh viện Bệnh Nhiệt Đới |
249 |
25 |
274 |
|
Tổng |
665 |
367 |
1032 |
|
KẾT LUẬN
Trong 6 tháng đầu năm 2012, Trung tâm DI & ADR Quốc gia đã tiếp nhận 1048 báo cáo ADR được gửi từ 212 cơ sở điều trị và 11 đơn vị sản xuất, kinh doanh dược phẩm. Đối tượng thực hiện báo cáo chủ yếu là bác sĩ, phần lớn báo cáo được gửi từ các đơn vị ở phía Nam, từ các bệnh viện tuyến tỉnh, bệnh viện đa khoa và bệnh viện thuộc khối công lập. Chất lượng báo cáo đã cải thiện nhưng vẫn còn thấp, rất ít báo cáo ADR có thông tin về các xét nghiệm chuyên biệt như thăm dò chức năng gan, xét nghiệm máu... đặc biệt thiếu báo cáo ADR nghiêm trọng và hiếm gặp. Với hoạt động giám sát chủ động ADR của thuốc ARV, chương trình đã hoàn thành việc tuyển chọn bệnh nhân, đạt được số lượng mẫu dự kiến và đang tiếp tục giai đoạn theo dõi bệnh nhân.

