
Nội dung bài
CHỐNG CHỈ ĐỊNH PROMETHAZIN ĐƯỜNG UỐNG CHO TRẺ EM DƯỚI 6 TUỔI: THÔNG TIN TỪ CƠ QUAN QUẢN LÝ DƯỢC PHẨM AUSTRALIA (TGA)
Ngày 19/11/2024, TGA đã đưa ra khuyến cáo chống chỉ định các thuốc chứa promethazin đường uống cho trẻ dưới 6 tuổi do nguy cơ gặp tác dụng không mong muốn trên hệ thần kinh trung ương và tâm thần. Trước đó, ngày 13/05/2024, Cơ quan An toàn Thuốc và Thiết bị Y tế New Zealand (Medsafe) cũng đã đưa ra khuyến cáo tương tự.
Nhà sản xuất của biệt dược gốc Phenergan đã tiến hành đánh giá dữ liệu an toàn của thuốc trên trẻ từ 2 đến 5 tuổi. Kết quả cho thấy có mối quan hệ nhân quả giữa việc sử dụng promethazin (và các chế phẩm phối hợp) và nguy cơ gặp tác dụng không mong muốn trên hệ thần kinh trung ương và tâm thần trên nhóm đối tượng này. Trước đó, vào tháng 03/2018, TGA khuyến cáo chống chỉ định các thuốc kháng histamin thế hệ 1, trong đó có các chế phẩm dạng dung dịch uống chứa promethazin cho trẻ dưới 2 tuổi do nguy cơ suy hô hấp, có thể dẫn đến tử vong. Kể từ ngày 01/09/2020, tất cả các thuốc không kê đơn (OTC) đường uống chứa thuốc kháng histamin thế hệ 1 có tác dụng an thần được yêu cầu phải có cảnh báo “Không sử dụng cho trẻ em dưới 2 tuổi”. Các chế phẩm uống điều trị ho, cảm lạnh và cúm cũng phải có cảnh báo: “Không sử dụng cho trẻ em dưới 6 tuổi” và “Chỉ nên sử dụng cho trẻ em từ 6 đến 11 tuổi theo khuyến cáo của bác sĩ, dược sĩ hoặc điều dưỡng”. Ngày 11/08/2022, TGA đưa ra cảnh báo nhắc lại cho nhân viên y tế và bệnh nhân về việc không sử dụng thuốc kháng histamin thế hệ 1 để điều trị các triệu chứng ho, cảm lạnh và cúm ở trẻ em dưới 6 tuổi. Thuốc cũng chống chỉ định cho trẻ dưới 2 tuổi với tất cả các chỉ định.
Khuyến cáo dành cho nhân viên y tế:
- Nhân viên y tế cần lưu ý đến thông tin cập nhật và tư vấn phù hợp cho cha mẹ hoặc người chăm sóc trẻ có ý định sử dụng các thuốc chứa promethazin dạng uống cho trẻ dưới 6 tuổi.
- Tư vấn về các thuốc thay thế cho cha mẹ và người chăm sóc trẻ.
- Trong thời gian để các thuốc tại nhà thuốc cập nhật nhãn mới, khuyến cáo không sử dụng promethazin dạng uống cho trẻ dưới 6 tuổi.
Không áp dụng khuyến cáo này với thuốc chứa promethazin đường tiêm, do chế phẩm này là thuốc kê đơn.
---------------------------------------------------------------------------------------------------------------------------------------------------------------------
CẬP NHẬT CẢNH BÁO ĐẶC BIỆT VỀ TÁC DỤNG KHÔNG MONG MUỐN TRÊN TÂM THẦN KINH KHI SỬ DỤNG MONTELUKAST: THÔNG TIN TỪ TGA
Ngày 16/01/2025, TGA thông báo bổ sung Cảnh báo đặc biệt kèm theo hướng dẫn xử trí biến cố trên tâm thần kinh cho bác sĩ kê đơn và bệnh nhân khi sử dụng montelukast. Các thông tin an toàn này nhằm nhấn mạnh thêm cho cảnh báo hiện có về biến cố nghiêm trọng trên tâm thần kinh (bao gồm cả thay đổi hành vi, trầm cảm và có ý định tự sát) khi sử dụng thuốc này.
Từ tháng 07/2018, TGA đã tiến hành đánh giá mối liên quan giữa việc sử dụng montelukast và biến cố bất lợi trên tâm thần kinh, rà soát dữ liệu y văn, tham vấn ý kiến từ các Cơ quan Quản lý (CQQL) trên thế giới và xin tư vấn chuyên môn của Ủy ban Tư vấn về thuốc của Úc (ACM). Đến năm 2024, độ an toàn của montelukast tiếp tục được đánh giá lại, sau khi các CQQL Dược phẩm trên thế giới tăng cường cảnh báo về nguy cơ gặp tác dụng không mong muốn trên tâm thần kinh. Các chuyên gia của ACM đưa ra kết luận không phát sinh nguy cơ mới, đồng thời, bằng chứng về mối liên quan giữa biến cố tâm thần kinh và việc sử dụng montelukast hiện chưa chắc chắn.
Tính đến ngày 18/12/2024, Cơ sở dữ liệu Cảnh giác Dược của Úc ghi nhận 356 báo cáo biến cố rối loạn tâm thần kinh khi sử dụng montelukast. Các triệu chứng được ghi nhận phổ biến nhất bao gồm hung hăng (100 báo cáo), lo âu (87 báo cáo), có ý định tự sát (72 báo cáo), trầm cảm (71 báo cáo), mất ngủ (52 báo cáo) và gặp ác mộng (50 báo cáo). Trong 91 báo cáo đề cập đến hành vi tự sát, có 10 báo cáo có hậu quả tử vong. Từ đó, ACM khuyến cáo, từ tháng 01/2025, thông tin sản phẩm của các thuốc chứa montelukast cần cập nhật thêm Cảnh báo đặc biệt để tương đồng với các CQQL dược phẩm khác trên thế giới.
Khuyến cáo dành cho nhân viên y tế:
- Nhân viên y tế cần được cảnh báo về nguy cơ gặp biến cố trên tâm thần kinh khi sử dụng montelukast. Biến cố này đã được ghi nhận trên mọi độ tuổi, thường ở mức độ nhẹ và có thể xảy ra ở bất kỳ bệnh nhân nào. Tuy nhiên, triệu chứng có thể trầm trọng hơn nếu tiếp tục sử dụng thuốc sau khi xảy ra biến cố. Một số trường hợp hiếm gặp ghi nhận bệnh nhân tử vong sau khi có ý định tự sát.
- Nhân viên y tế cần theo dõi sát triệu chứng tâm thần kinh của bệnh nhân và ngừng sử dụng montelukast trong trường hợp bệnh nhân xuất hiện triệu chứng tâm thần kinh mới hoặc trầm trọng hơn.
- Khuyến khích bệnh nhân và người chăm sóc theo dõi các biến cố tâm thần kinh và đi khám ngay nếu xuất hiện triệu chứng này. Trong nhiều trường hợp, triệu chứng thuyên giảm khi ngừng sử dụng thuốc; tuy nhiên một số trường hợp ghi nhận triệu chứng vẫn còn dai dẳng sau khi ngừng thuốc. Với những trường hợp đó, bệnh nhân cần được theo dõi chặt chẽ dưới sự giám sát của nhân viên y tế. Bác sĩ kê đơn cần thận trọng đánh giá lợi ích và nguy cơ của việc tiếp tục sử dụng montelukast ở bệnh nhân đã từng gặp biến cố trên tâm thần kinh khi dùng thuốc.
---------------------------------------------------------------------------------------------------------------------------------------------------------------------
MỞ RỘNG CHỐNG CHỈ ĐỊNH CỦA THIOCOLCHICOSID DO NGUY CƠ ĐỘT BIẾN GEN TIỀM ẨN: THÔNG TIN TỪ CƠ QUAN QUẢN LÝ DƯỢC PHẨM PHÁP (ANSM)
Ngày 5/2/2025, ANSM đưa ra các khuyến cáo mới nhằm giảm thiểu nguy cơ đột biến gen tiềm ẩn khi sử dụng thuốc chứa thiocolchicosid, bao gồm mở rộng chống chỉ định trên nam giới không sử dụng biện pháp tránh thai hiệu quả cao. Đồng thời, thời gian sử dụng biện pháp tránh thai sau khi ngừng sử dụng thuốc là 1 tháng đối với nữ giới và 3 tháng đối với nam giới.
Thiocolchicosid là thuốc có nguy cơ gây đột biến gen, do đó, thuốc đã bị chống chỉ định trên phụ nữ có thai, phụ nữ cho con bú, nữ giới trong độ tuổi sinh sản không sử dụng biện pháp tránh thai có hiệu quả cao. Các nghiên cứu tiền lâm sàng trên động vật với liều dùng đường uống tối đa hàng ngày 16 mg (8 mg x 2 lần/ngày) cho thấy chất chuyển hóa của thuốc gây ra hiện tượng lệch bội (bất thường về số lượng nhiễm sắc thể sau khi phân chia tế bào), dẫn đến thay đổi DNA của giao tử đực và cái. Hiện tượng lệch bội là một yếu tố nguy cơ gây dị tật thai nhi, độc bào thai, tăng nguy cơ sảy thai, suy giảm khả năng sinh sản của nam giới và có thể dẫn đến ung thư. Nguy cơ tăng lên khi thời gian phơi nhiễm với thuốc kéo dài.
Nhằm giảm thiểu nguy cơ tổn thương ADN do thuốc và đảm bảo giao tử không bị ảnh hưởng tại thời điểm thụ thai, bệnh nhân được khuyến cáo sử dụng biện pháp tránh thai có hiệu quả cao trong những khoảng thời gian sau:
- Trong suốt thời gian sử dụng thuốc (đối với cả nam giới và nữ giới trong độ tuổi sinh sản);
- Sau khi ngừng sử dụng thuốc: 1 tháng đối với nữ giới, và 3 tháng đối với nam giới.
---------------------------------------------------------------------------------------------------------------------------------------------------------------------
LOẠI BỎ CHỈ ĐỊNH GIẢM ĐAU SAU PHẪU THUẬT CỦA CÁC THUỐC OPIOID DẠNG GIẢI PHÓNG KÉO DÀI: THÔNG TIN TỪ CƠ QUAN QUẢN LÝ DƯỢC PHẨM ANH (MHRA)
Ngày 12/03/2025, MHRA thông báo không tiếp tục cấp phép cho chỉ định giảm đau sau phẫu thuật của tất cả các dẫn chất opioid dạng giải phóng kéo dài do tăng nguy cơ sử dụng opioid kéo dài sau phẫu thuật và suy hô hấp do opioid.
Các dẫn chất opioid dạng giải phóng kéo dài (giải phóng biến đổi) được chỉ định giảm đau mức độ từ trung bình đến nặng và đau do ung thư. Theo hướng dẫn điều trị của Viện Y tế và Chất lượng Điều trị Quốc gia Anh (National Institute of Health and Care Excellence – NICE), các thuốc opioid không được khuyến cáo trong các trường hợp đau mạn tính nguyên phát khi không có tình trạng bệnh lý nền gây đau. Một số dẫn chất opioid giải phóng kéo dài chứa morphin hoặc
oxycodon được cấp phép giảm đau sau phẫu thuật. Tuy nhiên, gần đây, MHRA đã ghi nhận tình trạng gia tăng của việc sử dụng opioid kéo dài sau phẫu thuật (persistent post-operative opioid – PPOU) và suy hô hấp do opioid (opioid-induced ventilatory impairment – OIVI).
PPOU được định nghĩa là việc sử dụng các dẫn chất opioid kéo dài quá 90 ngày sau phẫu thuật. Kết quả đánh giá dữ liệu từ các nước trong Liên minh Châu Âu và Vương quốc Anh, cho thấy tỷ lệ PPOU dao động từ 2% đến 44% bệnh nhân được điều trị bằng opioid dạng giải phóng kéo dài. Trong đó, PPOU cũng được ghi nhận phổ biến hơn (chiếm khoảng 60%) ở những bệnh nhân đã sử dụng opioid dạng giải phóng kéo dài trước phẫu thuật. Suy hô hấp là một tác dụng không mong muốn đã ghi nhận được của opioid, đặc biệt khi dùng quá liều hoặc kết hợp với các thuốc an thần khác (ví dụ: dẫn chất benzodiazepin, pregabalin hoặc gabapentin) có thể dẫn đến hôn mê và tử vong. Trong đó, OIVI là tình trạng suy hô hấp nghiêm trọng, với tần suất dao động từ 0,4% đến 41%. OIVI đặc trưng bởi các biểu hiện: ức chế trung tâm hô hấp (giảm tần số và/hoặc độ sâu của nhịp thở), an thần (giảm tỉnh táo), tắc nghẽn đường hô hấp trên (giảm trương lực cơ đường hô hấp trên).
Sau khi MHRA hoàn tất việc đánh giá an toàn và xin tư vấn từ Ủy ban thuốc sử dụng cho người (CHM), MHRA thông báo không tiếp tục cấp phép cho chỉ định giảm đau sau phẫu thuật của các thuốc morphin giải phóng kéo dài và oxycodon giải phóng kéo dài. Các opioid giải phóng kéo dài còn lại cũng sẽ không được khuyến cáo để giảm đau cấp tính sau phẫu thuật, thậm chí, không được chỉ định trong điều trị cơn đau cấp tính hoặc chống chỉ định trong các trường hợp này.
Khuyến cáo kê đơn trong giảm đau sau phẫu thuật
Cơn đau sau phẫu thuật thường không kéo dài, khoảng từ 5 đến 7 ngày, do đó, chỉ cần giảm đau ngắn hạn bằng opioid dạng giải phóng tức thì. Tuy nhiên, nhiều bệnh nhân xuất viện được kê đơn các thuốc giảm đau opioid với liều vượt quá nhu cầu kiểm soát cơn đau cấp tính sau phẫu thuật. Điều này làm tăng nguy cơ PPOU, lệ thuộc, nghiện hoặc nguy cơ lạm dụng opioid và OIVI.
Do đó, MHRA khuyến cáo bệnh nhân chỉ nên được kê đơn thuốc opioid giải phóng tức thì với với liều thấp nhất có hiệu quả khi xuất viện. Bên cạnh đó, nhiều hướng dẫn điều trị hiện tại cũng đồng thuận rằng việc sử dụng opioid trước phẫu thuật cần được đánh giá lại trước khi tiến hành phẫu thuật.
Yếu tố nguy cơ gặp phản ứng có hại nghiêm trọng liên quan đến các thuốc opioid
Có thể cần hiệu chỉnh liều hoặc chế độ dùng thuốc giảm đau opioid ở những bệnh nhân có nguy cơ cao, bao gồm:
- Bệnh nhân cao tuổi (> 65 tuổi);
- Suy giảm chức năng hô hấp hoặc mắc các bệnh lý hô hấp;
- Bệnh nhân có bệnh lý thần kinh, tim mạch;
- Suy giảm chức năng thận;
- Đang sử dụng đồng thời các thuốc ức chế thần kinh trung ương;
- Có tình trạng dung nạp opioid;
- Có sử dụng opioid trước phẫu thuật.
Khuyến cáo dành cho nhân viên y tế
Các thuốc opioid dạng giải phóng kéo dài được chỉ định để giảm đau trong trường hợp đau nặng và kéo dài, không nên sử dụng trong trường hợp đau cấp tính sau phẫu thuật.
Các thuốc opioid dạng giải phóng kéo dài có liên quan đến nguy cơ PPOU và OIVI, dẫn đến suy hô hấp nghiêm trọng, an thần, giảm trương lực cơ đường hô hấp trên.
Trước phẫu thuật, nhân viên y tế nên trao đổi với bệnh nhân về:
- Nguy cơ sử dụng opioid kéo dài sau phẫu thuật, từ đó tiềm ẩn nguy cơ lệ thuộc thuốc, nghiện thuốc và triệu chứng cai thuốc.
- Nguy cơ suy hô hấp do opioid, đặc biệt đối với bệnh nhân có bệnh lý hô hấp tiềm ẩn.
- Sử dụng thuốc opioid dạng giải phóng tức thì trong trường hợp đau cần điều trị bằng opioid trong thời gian ngắn.
- Chiến lược giảm đau cho bệnh nhân bao gồm: sử dụng opioid dạng giải phóng tức thì, phương pháp giảm đau đa mô thức và kế hoạch kết thúc điều trị.
- Bệnh nhân đang điều trị bằng opioid trước phẫu thuật nên được đánh giá điều trị trước và sau phẫu thuật dựa theo hướng dẫn điều trị
Khi bệnh nhân xuất viện, nhân viên y tế cần:
- Kê đơn opioid dạng giải phóng tức thì với liều thấp nhất có hiệu quả trong điều trị đau cấp tính sau phẫu thuật để giảm thiểu nguy cơ PPOU, lệ thuộc thuốc, dự trữ thừa opioid và nguy cơ lạm dụng opioid.
- Trao đổi về chiến lược giảm đau với các cơ sở y tế ban đầu trong tiếp nhận và chăm sóc cho bệnh nhân trong cộng đồng, đồng thời ghi lại đầy đủ thông tin trong hồ sơ của bệnh nhân.
- Báo cáo các trường hợp gặp phản ứng có hại như lệ thuộc thuốc hoặc suy hô hấp liên quan các opioid.
---------------------------------------------------------------------------------------------------------------------------------------------------------------------
MỘT SỐ ĐIỂM LƯU Ý KHI SỬ DỤNG METHOTREXAT: THÔNG TIN TỪ CƠ QUAN QUẢN LÝ DƯỢC PHẨM NEW ZEALAND (MEDSAFE)
Trong năm 2024, 101 báo cáo ca phản ứng có hại liên quan đến methotrexat đã được ghi nhận tại New Zealand. Trong đó, 89 trường hợp được đánh giá ở mức độ nghiêm trọng. Về đặc điểm của bệnh nhân trong các báo cáo, phần lớn là người cao tuổi (tuổi trung vị 66 tuổi), người gốc châu Âu/chủng tộc khác (71 báo cáo), nữ giới (71 báo cáo) và được chỉ định methotrexat trong điều trị vảy nến và viêm khớp dạng thấp. Các phản ứng có hại được báo cáo thường xuyên nhất bao gồm: buồn nôn (12 báo cáo), viêm phổi (10 báo cáo), giảm ba dòng tế bào máu (10 báo cáo), loét miệng (7 báo cáo), viêm phổi kẽ (6 báo cáo), mệt mỏi (5 báo cáo), giảm tiểu cầu (5 báo cáo), đau đầu (4 báo cáo), tăng men gan (4 báo cáo), giảm bạch cầu trung tính (4 báo cáo), nhiễm trùng huyết (4 báo cáo).
Để điều trị vảy nến hay viêm khớp dạng thấp, cần lưu ý tần suất sử dụng methotrexat là hàng tuần (1 lần/tuần). Việc sử dụng methotrexat hàng ngày làm tăng nguy cơ xuất hiện độc tính nghiêm trọng của thuốc, thậm chí gây tử vong cho người bệnh. Nguy cơ này cao hơn khi sử dụng methotrexat ở mức liều trên 20 mg mỗi tuần.
Phản ứng có hại liên quan đến methotrexat
Methotrexat có thể gây ra các phản ứng có hại nghiêm trọng trên nhiều hệ cơ quan trong cơ thể. Cụ thể được trình bày tại bảng dưới đây:
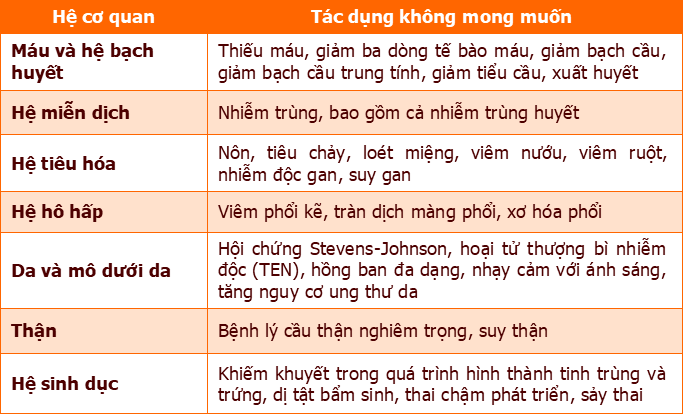
Sử dụng thuốc trong thai kỳ và thời kỳ cho con bú
Methotrexat chống chỉ định trong thai kỳ vì nguy cơ gây dị tật bẩm sinh. Do đó, khi đang điều trị bằng
methotrexat, bệnh nhân cần sử dụng biện pháp tránh thai hiệu quả trong suốt thời gian điều trị và sau khi ngừng thuốc (ít nhất 3 tháng đối với nam giới và ít nhất 6 tháng đối với nữ giới).
Methotrexat cũng chống chỉ định sử dụng trong thời kỳ cho con bú.
Thông tin dành cho nhân viên y tế
Methotrexat chỉ nên được kê đơn bởi các bác sĩ có kinh nghiệm trong việc sử dụng methotrexat và nắm rõ nguy cơ khi sử dụng thuốc này.
Trước khi khởi đầu điều trị với methotrexat, bệnh nhân cần được tiến hành xét nghiệm công thức máu, đánh giá chức năng gan và thận, chụp X-quang ngực. Đồng thời, khai thác tiền sử bệnh gan, sử dụng rượu hoặc tình trạng loét đường tiêu hóa. Dựa trên đánh giá lâm sàng, bác sĩ có thể chỉ định xét nghiệm sàng lọc lao, viêm gan B, viêm gan C và xét nghiệm thai kỳ.
Trong quá trình điều trị cần:
- Theo dõi công thức máu, chức năng gan và thận trong suốt quá trình điều trị bằng methotrexat. Đặc biệt, cần làm các xét nghiệm này thường xuyên hơn trong giai đoạn đầu điều trị, khi tăng liều methotrexat, khi chức năng thận của bệnh nhân biến đổi hoặc khi sử dụng đồng thời với các thuốc có tương tác với methotrexat hoặc ở bệnh nhân nguy cơ cao (như bệnh nhân cao tuổi).
- Có thể bổ sung acid folic và acid folinic khi sử dụng methotrexat để giảm nguy cơ gặp độc tính trên đường tiêu hóa.
- Nhắc nhở bệnh nhân, gia đình hoặc người chăm sóc cần thông báo ngay lập tức cho bác sĩ điều trị nếu xuất hiện triệu chứng ngộ độc
methotrexat, bao gồm: đau họng, bầm tím, loét miệng, buồn nôn, nôn, bụng khó chịu, nước tiểu sẫm màu, khó thở hoặc ho.
- Theo dõi bệnh nhân thường xuyên để đánh giá đáp ứng điều trị, phát hiện độc tính và xử trí kịp thời.
- Đảm bảo bệnh nhân, gia đình hoặc người chăm sóc hiểu đúng số lượng viên thuốc cần uống, ngày uống thuốc trong tuần và cách xử lý trong trường hợp quên liều.

