
Tóm tắt
Nội dung bài
Dược động học của các thuốc kháng nấm
Các đặc điểm dược động học là yếu tố quan trọng cần cân nhắc trong lựa chọn thuốc kháng nấm. Đặc biệt khi các nghiên cứu hiện nay cho thấy có nhiều sự khác biệt giữa các đặc điểm dược động học các thuốc kháng nấm trên bệnh nhân nhi và người lớn [4].
Nhóm polyen với đại điện là amphotericin B, hiện đang lưu hành ở Việt Nam với 2 dạng bào chế khác nhau bao gồm: amphotericin B deoxycholat (dạng bào chế quy ước) và amphotericin B phức hợp lipid (dạng bào chế lipid). Tương tự người lớn, ở trẻ em dạng bào chế lipid của vẫn có những ưu điểm vượt trội về dược động học như hấp thu nhanh, thể tích phân bố lớn và thời gian bán thải dài hơn đồng thời độc tính trên thận giảm đáng kể so với dạng quy ước [4], [5]. Đáng lưu ý, ở trẻ sơ sinh non tháng, amphotericin B có khả năng thâm nhập vào hệ thần kinh trung ương với nồng độ đạt khoảng 40%-90% nồng độ trong huyết thanh, trong khi sự thâm nhập này kém hơn ở người lớn [5]. Hiện nay, amphotericin B dạng quy ước đang được khuyến cáo chỉ nên sử dụng trong trường hợp không sẵn có các dạng bào chế lipid [4]. Tuy nhiên, đối với trẻ sơ sinh, một số ít dữ liệu hồi cứu cho thấy rằng amphotericin B deoxycholat có thể hiệu quả hơn so với các dạng bào chế khác trong điều trị nhiễm nấm Candida xâm lấn [4].
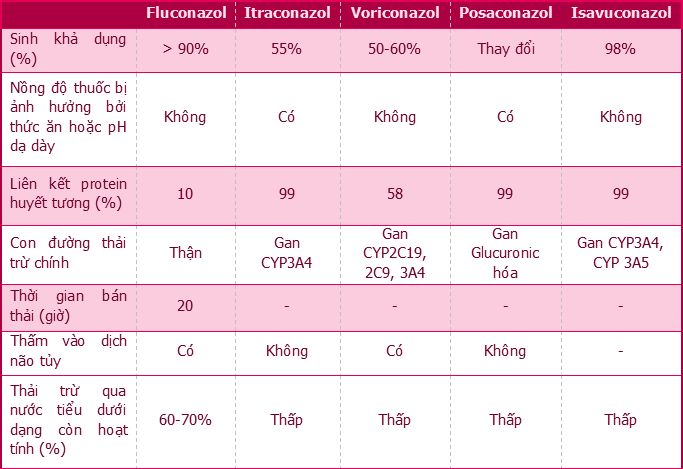
Nhóm azol hấp thu tốt qua đường tiêu hóa nên có thể dùng đường uống, tuy nhiên, đặc điểm dược động học giữa các thuốc rất khác nhau. Dữ liệu dược động học ở trẻ em của các dẫn chất azol, đặc biệt là itraconazol, còn rất hạn chế. Voriconazol chỉ đang được cấp phép sử dụng cho các chỉ định ở trẻ từ 2 tuổi trở lên trong khi posaconazol (dạng hỗn dịch uống và dạng viên nén) cho được phê duyệt sử dụng cho trẻ từ 13 tuổi trở lên còn dạng tiêm tĩnh mạch chỉ được cấp phép chỉ định cho bệnh nhân > 18 tuổi [6]. Các dữ liệu hiện có cho thấy một số điểm khác biệt về đặc điểm dược động học của các dẫn chất azol giữa người lớn và trẻ em. Cụ thể, thời gian bán thải (t1/2) của fluconazol là khoảng 20 giờ ở trẻ em so với 30 giờ ở người lớn. Voriconazol có sinh khả dụng cao ở người lớn (> 90%) nhưng sinh khả dụng lại thấp hơn đáng kể ở trẻ em (50-60%). Ở người lớn, voriconazol được chuyển hóa tuân theo mô hình dược động học không tuyến tính, trong khi ở trẻ em, thuốc có dược động học tuyến tính. Itraconazol và posaconazol có nhiều điểm tương đồng về dược động học ở trẻ em so với người lớn [7]. Các đặc điểm dược động học quan trọng giữa các thuốc kháng nấm nhóm azol trên bệnh nhân nhi trình bày trong Bảng 1 [4] ,[5], [8].
Bảng 1. Dược động học của các thuốc kháng nấm nhóm azol trên bệnh nhân nhi
Với 3 thuốc kháng nấm trong nhóm echinocandin, micafungin và anidulafungin, dược động học của người lớn và trẻ em được ghi nhận tương tự nhau. Riêng caspofungin có ghi nhận nhiều đặc điểm dược động học khác biệt so với người lớn. Đặc biệt hơn cả, ở bệnh nhân nhi, caspofungin ghi nhận sự biến thiên tương đối lớn giữa các thông số dược động học theo cân nặng và độ tuổi. Điều này cho thấy liều dùng tính theo cân nặng có thể chưa thực sự phản ánh tốt mức độ phơi nhiễm thuốc phù hợp cho tất cả các bệnh nhân nhi [7]. Ở trẻ em và thanh thiếu niên, caspofungin sử dụng liều 50 mg/m2 diện tích da cho thông số diện tích dưới đường cong (AUC) và nồng độ đáy (Ctrough) tương đương dữ liệu dược động học tương ứng của người lớn với liều 50 mg/ngày [7]. Các dẫn chất echinocandin hấp thu kém qua đường tiêu hóa nên phải dùng đường truyền tĩnh mạch đồng thời khả năng phân bố vào mắt, dịch não tủy hay đường tiết niệu kém [4]. Do đó, các thuốc này là một lựa chọn ưu tiên cho trẻ em nhiễm Candida xâm lấn không do bệnh liên quan đến mắt, hệ thần kinh trung ương hoặc đường tiết niệu.
Liều dùng và tối ưu chế độ liều các thuốc kháng nấm
Đối với amphotericin B các thông số dược động học khác nhau đáng kể trên bệnh nhân người lớn và trẻ em. Tuy nhiên do thuốc có thể tích phân bố tương đối lớn, thời gian bán thải dài nên liều khuyến cáo ở trẻ em không khác biệt nhiều so với liều khuyến cáo ở người lớn. Đặc biệt, amphotericin B có thể được sử dụng để điều trị nhiễm nấm xâm lấn trên cả trẻ sơ sinh, trẻ em và người lớn. Hiện nay, với bệnh nhân nhi, chế độ liều đang được khuyến cáo của amphotericin B đường tĩnh mạch là 1-1,5 mg/kg/ngày (dạng quy ước) và 3-5 mg/kg/ngày (dạng phức hợp lipid) [3], [9].
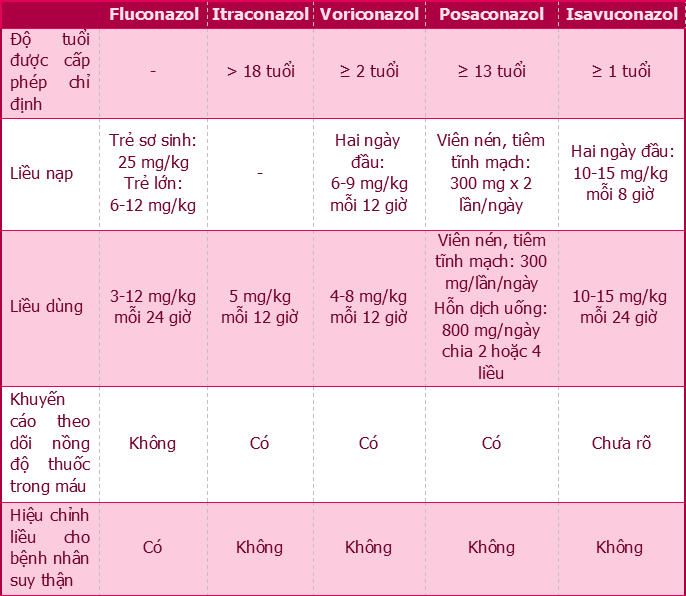
Khác với nhóm polyen, liều dùng của hầu hết các thuốc nhóm azol ở trẻ em thường được khuyến cáo nên cao hơn liều dùng cho người lớn. Để nhanh chóng đạt nồng độ thuốc trong máu, một số các azol thường được sử dụng một liều nạp (loading dose) vào ngày đầu tiên. Với fluconazol, liều nạp 25 mg/kg đã chứng minh hiệu quả giúp nhanh chóng đạt nồng độ thuốc trong máu đối với cả người lớn, trẻ em [10]. Các nghiên cứu về liều nạp đối các azol khác trên bệnh nhân nhi cho thấy rằng liều dùng của các thuốc kháng nấm ở trẻ em có thể cần cao hơn để có thể tạo ra nồng độ thuốc phơi nhiễm tương tự như người lớn. Cụ thể, voriconazol cần liều nạp 9 mg/kg ở trẻ thay vì 6 mg/kg ở người lớn, hay isavuconazol với liều nạp mỗi 8 giờ trong 2 ngày đầu là 10 mg/kg trong khi ở người lớn là 200 mg [11]. Hơn thế, chế độ liều duy trì hàng ngày ở trẻ em cũng được cho rằng cần liều cao hơn người lớn hoặc khoảng cách đưa liều ngắn hơn. Cụ thể do thời gian bán thải ngắn hơn nên liều dùng fluconazol hàng ngày nên tăng gấp đôi đối với trẻ em từ 3 tháng đến 16 tuổi là 6-12 mg/kg/ngày so với liều dùng được đề xuất ở người lớn (3-6 mg/kg/ngày) [3]. Ngoài ra, tuy dữ liệu lâm sàng rất hạn chế, litraconazol được khuyến cáo với liều duy trì ở trẻ em là 10 mg/kg/ngày chia 2 lần/ngày so với liều 200 mg mỗi ngày ở người lớn [4], [5]. Riêng với posaconazol, liều dùng ở dạng viên nén hoặc truyền tĩnh mạch hiện tại chưa được xác định đầy đủ trên bệnh nhân nhi tuy nhiên trẻ trong độ tuổi thanh thiếu niên được khuyến cáo có thể tuân thủ theo chế độ liều đang dùng trên người lớn [3]. Liều dùng của các thuốc kháng nấm nhóm azol được đề cập chi tiết tại Bảng 2 [4], [5], [6].
Bảng 2. Liều dùng các thuốc kháng nấm nhóm azol cho trẻ em
Để tối ưu hóa điều trị và giảm thiểu độc tính, 3 thuốc kháng nấm nhóm azol bao gồm itraconazol, voriconazol và posaconazol được khuyến cáo cần theo dõi nồng độ thuốc trong máu. Các nghiên cứu trên bệnh nhân nhi thường ghi nhận được nhiều sự khác biệt trong quá trình thanh thải các azol chống nấm và đặc biệt là sự biến thiên về mức độ phơi nhiễm thuốc lớn trên mỗi cá thể [12]. Do vậy, giám sát nồng độ thuốc trong máu (TDM) có vai trò quan trọng nhất là đối với các trường hợp nhiễm nấm do các chủng có giá trị MIC cao. Thêm vào đó, TDM còn có thể được chỉ định trong trường hợp để cân nhắc liệu pháp xuống thang chuyển kháng nấm đường tĩnh mạch sang đường uống, giám sát ảnh hưởng của các tương tác thuốc xuất hiện trong quá trình điều trị. Tuy nhiên, hiện tại các giá trị nồng độ đáy mục tiêu cần đạt mới được xác lập trên người lớn mà chưa được chứng minh đầy đủ trên bệnh nhân nhi [12].
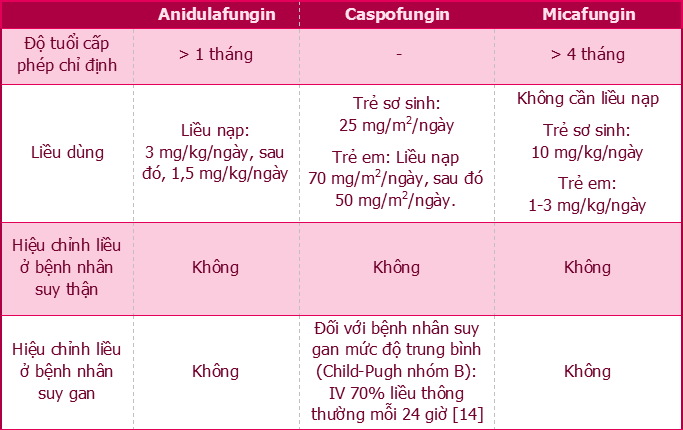
Các thuốc nhóm echinocandin, liều dùng khuyến cáo của micafungin và anidulafungin theo cân nặng của trẻ em khá tương đương với liều đang khuyến cáo trên người lớn. Trong khi đó, với caspofungin, việc ngoại suy liều dùng ở người lớn 50 mg/ngày thành liều trên trẻ em từ 2-17 tuổi dẫn đến sự giảm đáng kể (khoảng 46%) về diện tích dưới đường cong (AUC) của thuốc [13]. Tuy nhiên, nếu liều dùng được tính theo diện tích bề mặt cơ thể thì cho thấy AUC tương đương. Do đó, chế độ liều duy trì của caspofungin ở trẻ đang được khuyến cáo là 50 mg/m2 da/ngày [7]. Cần lưu ý, ba thuốc trong nhóm cũng có sự khác biệt về chế độ liều nạp và yêu cầu hiệu chỉnh liều ở bệnh nhân suy gan. Các đặc điểm này được đề cập chi tiết tại Bảng 3 [4], [6], [8].
Bảng 3. Liều dùng các thuốc kháng nấm nhóm echinocandin cho trẻ em
Tác dụng không mong muốn của các thuốc kháng nấm
Độc tính của các thuốc kháng nấm toàn thân luôn là vấn đề cần lưu ý khi sử dụng thuốc trên lâm sàng. Các tác dụng không mong muốn của các nhóm thuốc kháng nấm trên các hệ cơ quan khá tương tự nhau ở cả người lớn và trẻ em [4].
Amphotericin B có tác dụng không mong muốn điển hình ở cả người lớn và trẻ em là phản ứng liên quan đến tiêm truyền và độc tính trên thận. Độc tính trên thận của amphotericin B chủ yếu do giảm mức lọc cầu thận gây tăng nồng độ creatinin huyết thanh. Ngoài ra, amphotericin B gây bệnh lý ống thận có liên quan đến tình trạng hạ kali máu ở bệnh nhân. Do đó cần bổ sung kali cho trẻ sơ sinh và trẻ em đồng thời truyền tĩnh mạch NaCl 0,9% trước và sau khi truyền amphotericin B là biện pháp giúp giảm độc tính này [4]. Phản ứng liên quan đến tiêm truyền (sốt, rét run, đau đầu, đau khớp, nôn, buồn nôn và tụt huyết áp) có thể xảy ra, tuy nhiên, ít gặp ở trẻ sơ sinh và trẻ nhỏ hơn so với trẻ em ở độ tuổi thanh thiếu niên [15]. Phản ứng này có thể dự phòng bằng cách sử dụng paracetamol, diphenhydramin và corticosteroid như hydrocortison khoảng 30-60 phút trước khi truyền amphotericin B [4]. Trong hầu hết các nghiên cứu, các dạng bào chế lipid của amphotericin B cho thấy gây ra ít độc tính hơn đáng kể so với amphotericin B dạng quy ước [3]. Tuy nhiên, một nghiên cứu hồi cứu được thực hiện trên bệnh nhân nhi cho thấy không sự khác biệt về tác dụng không mong muốn liên quan đến phản ứng liên quan tiêm truyền hoặc độc tính với thận giữa 2 dạng bào chế này [15]. Đặc biệt, trẻ sơ sinh và trẻ nhỏ (< 13 tháng tuổi) có xu hướng dung nạp amphotericin B deoxycholat tốt hơn và ít bị độc tính hơn người lớn [5].
Tài liệu tham khảo
1. Ankrah AO, Sathekge MM, Dierckx RA, Glaudemans AW. Imaging fungal infections in children. Clin Transl Imaging. 2016;4:57-72.
2. Lehrnbecher T, Groll AH. Invasive fungal infections in the pediatric population. Expert Rev Anti Infect Ther. 2011;9(3):275-8.
3. Steimbach LM, Tonin FS, Virtuoso S, Borba HH, Sanches AC, Wiens A, et al. Efficacy and safety of amphotericin B lipid-based formulations-A systematic review and meta-analysis. Mycoses. 2017;60(3):146-54.
4. John S. Bradley M ea. Nelson’s Pediatric Antimicrobial Therapy. American Academy of Pediatrics. 2023.
5. Wolters Kluwer. Pediatric and Neonatal Lexi-Drugs.
6. U.S. Food and Drug Administration. Drug label information.
7. Blyth CC, Palasanthiran P, O'Brien TA. Antifungal therapy in children with invasive fungal infections: a systematic review. Pediatrics. 2007;119(4):772-84.
8. Cecinati V, Guastadisegni C, Russo FG, Brescia LP. Antifungal therapy in children: an update. Eur J Pediatr. 2013;172(4):437-46.
9. Bộ Y tế. Hướng dẫn chẩn đoán và điều trị nhiễm nấm xâm lấn. ban hành kèm theo QĐ 3429/QĐ-BYT. 2021.
10. Gerhart JG, Watt KM, Edginton A, Wade KC, Salerno SN, Benjamin DK, Jr., et al. Physiologically-Based Pharmacokinetic Modeling of Fluconazole Using Plasma and Cerebrospinal Fluid Samples From Preterm and Term Infants. CPT Pharmacometrics Syst Pharmacol. 2019;8(7):500-10.
11. Zembles TN, Thompson NE, Havens PL, Kaufman BA, Huppler AR. An Optimized Voriconazole Dosing Strategy to Achieve Therapeutic Serum Concentrations in Children Younger than 2 Years Old. Pharmacotherapy. 2016;36(10):1102-8.
12. Warris A, Lehrnbecher T, Roilides E, Castagnola E, Brüggemann RJM, Groll AH. ESCMID-ECMM guideline: diagnosis and management of invasive aspergillosis in neonates and children. Clin Microbiol Infect. 2019;25(9):1096-113.
13. Walsh TJ, Viviani MA, Arathoon E, Chiou C, Ghannoum M, Groll AH, et al. New targets and delivery systems for antifungal therapy. Med Mycol. 2000;38 Suppl 1:335-47.
14. Paediatric Formulary Committee. BNF for Children (2022 - 2023). Pharmaceutical Press. 2023:429.
15. Andrew EC, Curtis N, Coghlan B, Cranswick N, Gwee A. Adverse effects of amphotericin B in children; a retrospective
comparison of conventional and liposomal formulations. Br J Clin Pharmacol. 2018;84(5):1006-12.

