
Tóm tắt
Nội dung bài
Trong các phản ứng dị ứng toàn thân cấp tính, phản vệ là biểu hiện lâm sàng ở cấp độ nặng nhất [1]. Trong nhiều năm qua, hoạt động định kỳ về tổng kết báo cáo ADR tự nguyện và phân tích tín hiệu an toàn thuốc, đặc biệt là phản vệ, đã được Trung tâm DI & ADR Quốc gia triển khai.
Qua quá trình rà soát và phân tích trong Cơ sở dữ liệu báo cáo ADR tự nguyện trong vòng 6 năm (từ năm 2017 đến năm 2022), Trung tâm đã xác định 117 thuốc có sự hình thành tín hiệu phản vệ trong ít nhất một giai đoạn. Một số hoạt chất đã có sự hình thành tín hiệu phản vệ kể từ năm 2020, cho thấy đây là các tín hiệu mới cần được tiếp tục theo dõi và đánh giá trong các giai đoạn tiếp theo. Trong đó, đáng chú ý là tín hiệu phản vệ của hyoscin butylbromid (hay butylscopalamin) và cefamandol (Bảng 1).
Bảng 1. Tín hiệu phản vệ mới xuất hiện trong giai đoạn 2017-2022 đối với hyoscin butylbromid và cefamandol
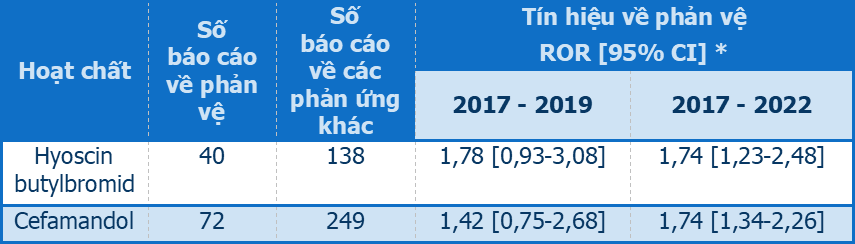
*ROR: Reporting Odds Ratio (tỷ suất chênh báo cáo);
Tín hiệu phản vệ được coi là hình thành nếu cận dưới khoảng tin cậy (CI) 95% của ROR > 1
Hyoscin butylbromid
Hyoscin butylbromid là một thuốc chống co thắt cơ trơn, có chỉ định trong các trường hợp co thắt đường tiêu hóa, đường mật, đường tiết niệu và hỗ trợ trong chẩn đoán hình ảnh (chụp X-quang) [2]. Với đường tiêm tĩnh mạch, cần lưu ý tiêm “chậm” do đã có một số trường hợp hiếm gặp ghi nhận về tụt huyết áp (thậm chí sốc) với hyoscin [3].
Trong Cơ sở dữ liệu báo cáo ADR tự nguyện tại Việt Nam từ năm 2017 đến năm 2022, đã có 40 báo cáo về phản vệ liên quan đến hyoscin butylbromid được ghi nhận. Tín hiệu phản vệ của thuốc đã được hình thành trong giai đoạn này với ROR = 1,74 (95% CI: 1,23-2,48).
Cơ sở dữ liệu về ADR của Tổ chức Y tế Thế giới (VigiLyze) phân tích sự hình thành tín hiệu thông qua chỉ số IC025, cho thấy chưa có tín hiệu phản vệ với hyoscin (IC025 = -1,8) [4]. Tuy nhiên, nguy cơ về phản ứng có hại nghiêm trọng của hyoscin butylbromid (bao gồm nhịp tim nhanh, hạ huyết áp và phản vệ) đã từng được cảnh báo bởi Cơ quan Quản lý Dược phẩm Anh (MHRA) và Australia (TGA), đặc biệt trên đối tượng có bệnh lý tim mạch [2], [5].
Vì vậy, khi sử dụng thuốc trên bệnh nhân cần khai thác kĩ tiền sử về bệnh lý mắc kèm của bệnh nhân, cân nhắc kĩ lợi ích - nguy cơ trước khi chỉ định các thuốc này, luôn giám sát chặt chẽ tình trạng bệnh nhân và đảm bảo sẵn có đội ngũ nhân viên y tế và các phương tiện hồi sức để xử trí phản vệ.
Cefamandol
Cefamandol là một kháng sinhcephalosporin thế hệ 2 có chỉ định tương đối rộng tại Việt Nam bao gồm điều trị các nhiễm khuẩn do các chủng vi khuẩn còn nhạy cảm và dự phòng nhiễm khuẩn trong phẫu thuật (mặc dù có các kháng sinh khác được ưu tiên hơn như cefazolin) [6]. Tuy nhiên, hiện thuốc này không còn được lưu hành tại Hoa Kỳ và nhiều quốc gia khác trên thế giới [7]. Do vậy, các thông tin cập nhật về cefamandol (bao gồm độ an toàn) là rất hạn chế. Trong một tổng quan các khuyến cáo về lựa chọn kháng sinh kinh nghiệm, cefamandol cũng chỉ được đề cập với vai trò kháng sinh dự phòng trong hướng dẫn của Hội Gây mê và Hồi sức Pháp (SFAR) ban hành năm 2018 [8]. Tuy nhiên, gần đây, do không còn lưu hành trên thị trường Pháp nên cefamandol cũng không có mặt trong phiên bản cập nhật năm 2024 của SFAR [9].
Cơ sở dữ liệu báo cáo ADR tự nguyện giai đoạn 2017-2022 ghi nhận 72 báo cáo về phản vệ liên quan đến cefamandol và có sự xuất hiện của tín hiệu phản vệ với ROR = 1,74 (95% CI: 1,34-2,26). Tín hiệu phản vệ của cefamandol cũng đã hình thành trong Cơ sở dữ liệu về ADR của Tổ chức Y tế Thế giới (VigiLyze) với chỉ số IC025 = 2,8 [4].
Cần lưu ý, nguy cơ dị ứng chéo khi sử dụng cefamandol trên những bệnh nhân có tiền sử dị ứng các kháng sinh penicillin là tương tự như các cephalosporin thế hệ 1 do có sự tương đồng về cấu trúc hóa học. Theo một tổng quan hệ thống, bệnh nhân có tiền sử dị ứng penicillin có nguy cơ gặp dị ứng cao hơn khi sử dụng các cephalosporin thế hệ 1 và cefamandol (OR = 4,8; 95% CI = 3,7-6,2), trong khi không thấy có sự gia tăng nguy cơ này với các cephalosporin thế hệ 2 khác và các cephalosporin thế hệ 3 [10].
Để giảm thiểu nguy cơ phản vệ, việc sử dụng kháng sinh này cần được cân nhắc trong bối cảnh có những lựa chọn ưu tiên hơn, đồng thời cần khai thác kỹ tiền sử bệnh nhân, chỉ sử dụng cefamandol trong trường hợp cần thiết, phù hợp với chỉ định và giám sát chặt chẽ các ADR trong quá trình sử dụng kháng sinh này.
Tài liệu tham khảo
1. Cardona et al. (2020), "World Allergy Organization Anaphylaxis Guidance 2020", World Allergy Organization Journal, 13(10), pp. 1-3.
2. Therapeutic Goods Administration (2017), "New precautions for hyoscine butylbromide ampoules", Medicines Safety Update, 8(4), pp. 2-3.
3. The electronic medicines compendium (emc), Hyoscine butylbromide 20 mg/ml solution for injection - Summary of Product Characteristics.
4. Uppsala Monitoring Centre, Retrieved July, 2024, from https://who-umc.org/.
5. Medicines and Healthcare products Regulatory Agency (2017), "Hyoscine butylbromide (Buscopan) injection: risk of serious adverse effects in patients with underlying cardiac disease", Drug Safety Update, 10(7), pp. 2.
6. Bộ Y tế (2022), Chuyên luận Cefamandol - Dược thư Quốc gia Việt Nam, lần xuất bản thứ ba - Tập I.
7. M. Lindsay Grayson, Sara E. Cosgrove Suzanne M. Crowe, M. Lindsay Grayson, William Hope, James S. McCarthy, John Mills, Johan W. Mouton, David L. Paterson, Kucers' The Use of Antibiotics. 2018, Taylor & Francis Group. p. 396-397.
8. Moja L., Zanichelli V., et al. (2024), "WHO's essential medicines and AWaRe: recommendations on first- and second-choiceantibiotics for empiric treatment of clinicalinfections", Clin Microbiol Infect, 30 Suppl 2, pp. S1-s51.
9. De la SOCIETE FRANÇAISE D’ANESTHESIE ET REANIMATION (SFAR) (2024), "Antibioprophylaxie en chirurgie et médecine interventionnelle", pp.
10. Pichichero M. E., Casey J. R. (2007), "Safe use of selected cephalosporins in penicillin-allergic patients: a meta-analysis", Otolaryngol Head Neck Surg, 136(3), pp. 340-7.

