
Tóm tắt
Nội dung bài
Ca lâm sàng
Ca lâm sàng thứ 1: Bệnh nhân nữ, 46 tháng, 7 kg, tiền sử bại não - động kinh, được chẩn đoán viêm phổi và được chỉ định ceftriaxon 700mg x 1 lần/ngày tiêm tĩnh mạch. Bệnh nhân dùng thuốc đến ngày thứ 9 xuất hiện da xanh, niêm mạc rất nhợt, refill > 2h, mạch ngoại vi không bắt được, mạch trung tâm bắt yếu. Kết quả xét nghiệm: số lượng hồng cầu 1,23 T/L (4,0 - 5,4), hemoglobin 3,6 g/dL (12 - 16), hematocrit 9,5% (37 - 47) (trước khi dùng ceftriaxon, các chỉ số trên trong khoảng giá trị bình thường). Bệnh nhân được chẩn đoán theo dõi cơn tan máu cấp, suy hô hấp. Bệnh nhân được cấp cứu ngưng tuần hoàn, bóp bóng qua nội khí quản, ép tim ngoài lồng ngừng, tiêm adrenalin, truyền khối hồng cầu rửa, truyền huyết tương tươi đông lạnh. Tuy nhiên, bệnh nhân tiên lượng rất nặng và người nhà xin về.
Ca lâm sàng thứ 2: Bệnh nhân nữ, 47 tháng, 13 kg, viêm màng não được chỉ định ceftriaxon 1300 mg x 1 lần/ngày tiêm tĩnh mạch. Bệnh nhân dùng thuốc đến ngày thứ 15 xuất hiện cơn khóc thét, kích thích, sau đó giật toàn thể, cơn kéo dài 30 giây, tự cắt cơn. Sau đó, trẻ ngủ yên, tím tái trong cơn, da niêm mạch nhợt, tim đều, mạch rõ, chi ấm, tần số 118 chu kỳ/phút, huyết áp 95/68 mmHg. Kết quả xét nghiệm: số lượng hồng cầu 0,98 T/L (4,0 - 5,4), hemoglobin 3,8 g/dL (12 - 16), hematocrit 10,1% (37 - 47) (trước khi dùng ceftriaxon và ở các ngày thứ 3, ngày thứ 7 và ngày thứ 12 dùng thuốc, các chỉ số trên trong khoảng giá trị bình thường). Bệnh nhân được chẩn đoán thiếu máu nặng - tan máu miễn dịch cấp tính do ceftriaxon. Bệnh nhân được truyền khối hồng cầu từ 250 mL máu toàn phần, truyền Ringer lactat, midazolam (truyền tĩnh mạch) và phenobarbital (uống). Sau truyền máu và ngừng ceftriaxon, bệnh nhân hồi phục.
Cơ chế bệnh sinh
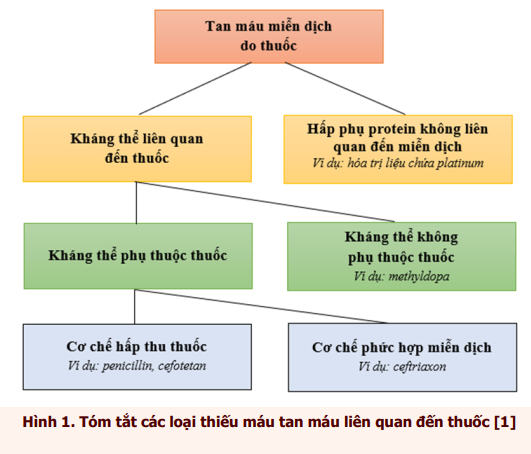
Trước hết, cần phân biệt phản ứng tan máu do thuốc bao gồm: phản ứng gây độc trực tiếp hồng cầu gây tan máu (như ribavirin) hoặc phản ứng tan máu miễn dịch liên quan đến thuốc, dẫn đến tan máu nội mạch hoặc ngoại mạch. Tan máu miễn dịch do thuốc có thể xảy ra thông qua cơ chế hình thành kháng thể liên quan đến thuốc hoặc cơ chế hấp phụ protein không phải miễn dịch. Kháng thể liên quan đến thuốc lại được chia thành hai loại: phụ thuộc thuốc và không phụ thuộc thuốc. Kháng thể phụ thuộc thuốc cần sự có mặt của thuốc (hoặc chất chuyển hóa của thuốc) để liên kết và gây ly giải hồng cầu. Trái lại, kháng thể không phụ thuộc thuốc hoạt động tương tự kháng thể tự miễn, chủ yếu liên kết với cấu trúc màng hồng cầu mà không cần có mặt của thuốc nghi ngờ. Với loại này, thuốc chỉ đóng một phần nhỏ và không đáng kể ở vị trí liên kết. Kháng thể không phụ thuộc thuốc ít gặp hơn so với kháng thể phụ thuộc thuốc [1]. Kháng thể phụ thuộc thuốc thường liên quan đến cefotetan, ceftriaxon và piperacilin. Trong khi đó, fludarabin, methyldopa và các chất ức chế beta-lactamase và hóa trị liệu chứa platinum thường là nguyên nhân gây kháng thể không phụ thuộc thuốc [2].
Phân tích sâu hơn nữa, các kháng thể phụ thuộc thuốc lại được phân biệt với nhau dựa trên cơ chế liên kết của thuốc với hồng cầu. Trong đó, nếu thuốc và hồng cầu liên kết theo cơ chế cộng hóa trị, sẽ dẫn đến phản ứng theo cơ chế hấp phụ thuốc hay phản ứng kiểu penicillin; còn nếu thuốc liên kết với hồng cầu bằng một liên kết lỏng kẻo hơn sẽ gây phản ứng kiểu phức hợp miễn dịch. Sơ đồ tóm tắt các loại tan máu miễn dịch do thuốc khác nhau được trình bày trong Hình 1 [1].
Thiếu máu tan máu do ceftriaxon thường do cơ chế hình thành phức hợp miễn dịch. Ceftriaxon và các chất chuyển hóa có thể liên kết với kháng thể trong huyết tương hình thành phức hợp miễn dịch. Các phức hợp miễn dịch liên kết không đặc hiệu với màng tế bào hồng cầu, kích hoạt bổ thể và gây phá hủy hồng cầu. Các phản ứng ly giải hồng cầu do kích hoạt bổ thể thường xảy ra trong lòng mạch. Các phản ứng này thường cấp tính, nặng, giải phóng hemoglobin vào huyết tương, xuất hiện hemoglobin trong nước tiểu. Trong những trường hợp nghiêm trọng, có hiện tượng giảm mạnh và đột ngột hemoglobin sau khi sử dụng thuốc [3]. Phản ứng thiếu máu tan máu ở trẻ em thường nặng và diễn tiến xấu, với khoảng 36% trường hợp ghi nhận hậu quả tử vong [4].
Biểu hiện lâm sàng và cận lâm sàng
Thiếu máu tan máu do thuốc thường xuất hiện sau khoảng vài ngày đến vài tuần sau khi sử dụng thuốc. Các triệu chứng có thể bao gồm: mệt mỏi, vàng da, chán ăn, đau bụng. Đa số các triệu chứng này liên quan đến phản ứng tan máu [5]. Với các trường hợp nặng, có thể có các triệu chứng xanh xao, mất ý thức, co giật và hạ huyết áp xảy ra do hiện tượng thiếu máu cấp tính. Một số triệu chứng khác có thể bao gồm đau lưng dưới, giảm trương lực cơ. Trong đó, đau lưng thường liên quan đến sự lắng đọng của các mảnh vỡ hồng cầu bị phá hủy tại thận, còn giảm trương lực cơ thường do oxy không đủ cung cấp đến các mô khi số lượng hồng cầu giảm nhanh chóng [6].
Về cận lâm sàng, không có một xét nghiệm chẩn đoán đặc hiệu chuyên biệt cho thiếu máu tan máu. Thông thường, bệnh nhân có kết quả thiếu máu, hemoglobin thấp không có nguyên nhân rõ ràng. Bệnh nhân có số lượng hồng cầu lưới tăng không xuất phát từ nguyên nhân tăng sản xuất hồng cầu do gần đây có chảy máu hoặc do bổ sung sắt, vitamin B12, folat, đồng hoặc do sử dụng erythropoietin. Ngoài ra, xét nghiệm máu có thể ghi nhận các kết quả bất thường như haptoglobin thấp, nồng độ lactate dehydrogenase (LDH) cao, nồng độ bilirubin gián tiếp cao là dấu hiệu của hiện tượng phá hủy hồng cầu. Phết máu ngoại vi có thể phát hiện các hình thái hồng cầu bất thường như hồng cầu hình cầu (spherocytes) hoặc mảnh vỡ hồng cầu (schistocytes) [7].
Thiếu máu tan máu miễn dịch được đặc trưng bởi xét nghiệm kháng globulin trực tiếp (DAT hoặc xét nghiệm Coombs trực tiếp) dương tính và/hoặc xét nghiệm kháng globulin gián tiếp (IAT hoặc xét nghiệm Coombs gián tiếp) dương tính. Các xét nghiệm này giúp xác định tình trạng thiếu máu ở bệnh nhân có cơ chế miễn dịch hay không liên quan đến miễn dịch [7]. Trong đó, xét nghiệm Coombs trực tiếp dùng để phát hiện các kháng thể được gắn lên bề mặt hồng cầu, còn xét nghiệm Coombs gián tiếp dùng để phát hiện các kháng thể bất thường trong huyết thanh của bệnh nhân.
Biến chứng nặng của thiếu máu tan máu do thuốc bao gồm suy thận cấp, suy đa tạng và ngừng tim đột ngột. Bệnh nhân suy thận không chỉ do giảm tưới máu mà còn do độc tính trên thận của hemin và hemoglobin tự do, đặc biệt trong trường hợp có tắc nghẽn ống thận [3]. Cơn tan máu cấp là biến cố nguy hiểm có thể xảy ra khi thiếu máu tan máu xảy ra cấp tính, đột ngột cùng với sự gia tăng số lượng hồng cầu lưới [6]
Theo dõi và xử trí
Việc điều trị thiếu máu tan máu do thuốc phụ thuộc vào mức độ nặng của triệu chứng và tình trạng tan máu. Do đó, việc phát hiện sớm và xử trí kịp thời đóng vai trò quan trọng. Ngừng thuốc nghi ngờ là biện pháp cần thiết đầu tiên. Đa số các trường hợp phản ứng nhẹ đến trung bình thường cải thiện rõ rệt sau khi ngừng thuốc khoảng 2 tuần mặc dù phản ứng Coombs trực tiếp có thể dương tính hàng tháng. Các trường hợp phản ứng nặng (hemoglobin < 7 g/dL) cần truyền máu. Không nên trì hoãn việc truyền máu ở bệnh nhân nặng mặc dù khó xác định được máu có phản ứng chéo tương thích ở bệnh nhân có test Coombs dương tính. Bệnh nhân có thể cần thực hiện phương pháp trao đổi huyết tương hoặc lọc huyết tương nếu xảy ra sốc, tuy nhiên, các trường hợp này tương đối hiếm gặp [5].
Việc xác định cơ chế phản ứng thiếu máu tan máu xảy ra theo loại kháng thể phụ thuộc thuốc hay không phụ thuộc thuốc cũng giúp bác sĩ có hướng xử trí phù hợp. Đối với các trường hợp do kháng thể không phụ thuộc thuốc, bên cạnh việc ngừng thuốc, do có tính chất tương tự tự kháng kháng thể, bệnh nhân nên được điều trị như thiếu máu tan máu do kháng thể nóng, cụ thể là sử dụng corticoid và bổ sung immunoglobulin tĩnh mạch (IVIG) hoặc sử dụng thuốc ức chế miễn dịch nếu phản ứng nặng và dai dẳng. Tuy nhiên, thuốc có thể tạo ra các kháng thể theo nhiều cơ chế trên cùng một cá thể. Vì vậy, bác sĩ cần theo dõi chặt chẽ tình trạng và đáp ứng lâm sàng của bệnh nhân để xử trí kịp thời.
Riêng với ceftriaxon, một tổng kết cơ sở dữ liệu EMBASE, MEDLINE và cơ sở dữ liệu Cảnh giác Dược của Hoa Kỳ và Canada đến năm 2014 ghi nhận 37 ca thiếu máu tan máu miễn dịch liên quan đến ceftriaxon. 70% bệnh nhân có bệnh lý mắc kèm, trong đó, thiếu máu hồng cầu hình liềm là bệnh mắc kèm thường gặp nhất. Có đến 65% bệnh nhân đã từng sử dụng ceftriaxon trước đó và 59% bệnh nhân có hemoglobin mới phát hiện trong nước tiểu. Điều đó cho thấy tầm quan trọng của việc khai thác tiền sử sử dụng ceftriaxon và sàng lọc hemoglobin trong nước tiểu như một biện pháp giúp phát hiện sớm biến cố hiếm gặp nhưng nghiêm trọng này [8]. Bên cạnh đó, cần cân nhắc cẩn thận khi kê đơn các kháng sinh cephalosporin khác ở bệnh nhân có tiền sử thiếu máu tan máu liên quan đến ceftriaxon do nguy cơ xuất hiện phản ứng chéo. Một số kháng sinh trong nhóm cephalosporin đã được ghi nhận có phản ứng chéo in vitro với kháng thể ceftriaxon bao gồm: cefamandol, cefoperazon, cefotaxim [9].
Tóm lại, thiếu máu tan máu miễn dịch liên quan đến ceftriaxon nói riêng và thuốc nói chung là biến cố hiếm gặp nhưng nghiêm trọng và có nguy cơ tử vong cao. Việc điều trị thiếu máu tan máu do thuốc phụ thuộc vào mức độ nặng của triệu chứng và tình trạng tan máu. Phát hiện sớm và xử trí kịp thời đóng vai trò quan trọng, trong đó, ngừng thuốc nghi ngờ là biện pháp cần thiết đầu tiên.
Tài liệu tham khảo
1. Leicht H. B., Weinig E., et al. (2018), "Ceftriaxone-induced hemolytic anemia with severe renal failure: a case report and review of literature", BMC Pharmacol Toxicol, 19(1), pp. 67.
2. Pierce A., Nester T., et al. (2011), "Pathology consultation on drug-induced hemolytic anemia", Am J Clin Pathol, 136(1), pp. 7-12.
3. Northrop M. S., Agarwal H. S. (2015), "Ceftriaxone-induced hemolytic anemia: case report and review of literature", J Pediatr Hematol Oncol, 37(1), pp. e63-6.
4. Arndt P. A., Leger R. M., et al. (2012), "Serologic characteristics of ceftriaxone antibodies in 25 patients with drug-induced immune hemolytic anemia", Transfusion, 52(3), pp. 602-12.
5. Singh A., Singhania N., et al. (2020), "Ceftriaxone-Induced Immune Hemolytic Anemia", Cureus, 12(6), pp. e8660.
6. Tao E., Zhou H., et al. (2024), "Ceftriaxone-induced severe hemolytic anemia, renal calculi, and cholecystolithiasis in a 3-year-old child: a case report and literature review", Front Pharmacol, 15, pp. 1362668.
7. Barcellini W., Diagnosis of hemolytic anemia in the adult. 2024, UptoDate.
8. Neuman G., Boodhan S., et al. (2014), "Ceftriaxone-induced immune hemolytic anemia", Ann Pharmacother, 48(12), pp. 1594-604.
9. Garratty G. (2009), "Drug-induced immune hemolytic anemia", Hematology Am Soc Hematol Educ Program, 10.1182/asheducation-2009.1.73, pp. 73-9.

