
Tóm tắt
Nội dung bài
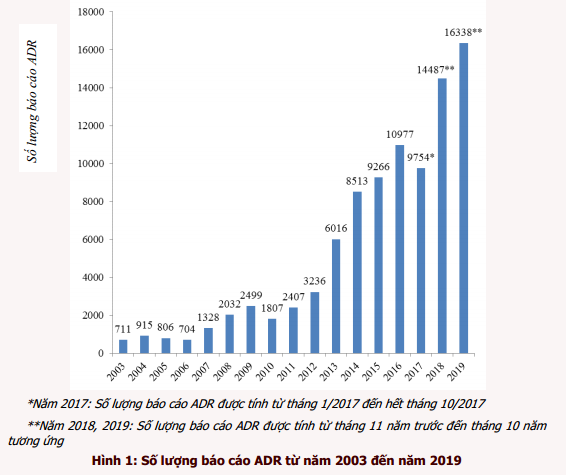
Số lượng báo cáo nhận được từ năm 2003 đến năm 2019 được trình bày trong hình 1.
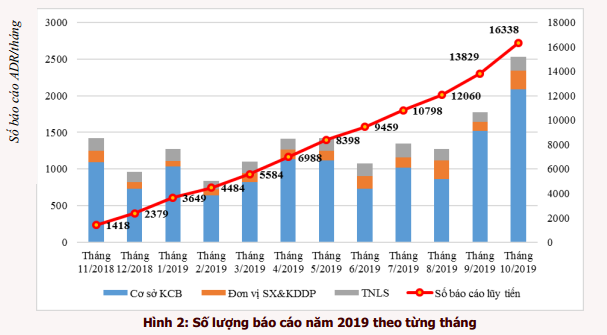
Trong số các báo cáo đã tiếp nhận, có 16229 (99,3%) báo cáo về biến cố bất lợi của thuốc, 69 (0,4%) báo cáo về chất lượng thuốc, 03 (0,02%) báo cáo về sai sót trong sử dụng thuốc và 37 (0,2%) báo cáo về các vấn đề khác (báo cáo liên quan đến thiết bị y tế, sử dụng với chỉ định chưa được phê duyệt, …). Chi tiết số lượng báo cáo đã nhận được lũy tiến theo từng tháng trong năm 2019 được trình bày trong hình 2.
I. BÁO CÁO ADR TỪ CÁC CƠ SỞ KHÁM, CHỮA BỆNH
1. Tình hình báo cáo từ các đơn vị
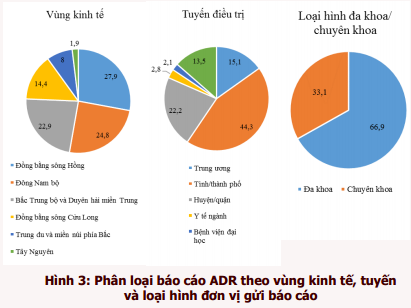
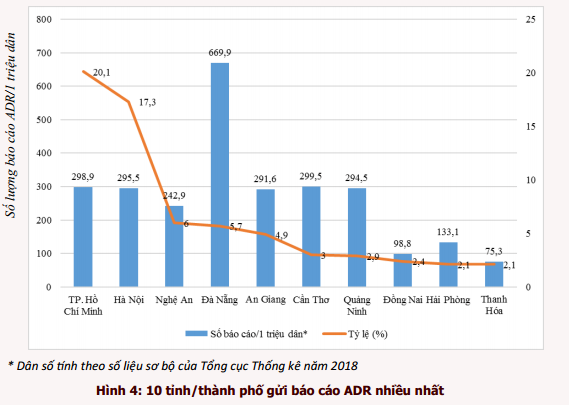
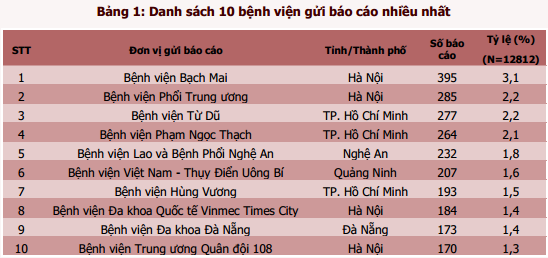
Năm 2019, 880 cơ sở khám bệnh, chữa bệnh của toàn bộ 63 tỉnh, thành phố trong cả nước đã gửi báo cáo ADR (tăng 14,7% so với năm 2018). Phần lớn báo cáo được gửi từ các đơn vị ở vùng đồng bằng sông Hồng và Đông Nam bộ, từ các bệnh viện tuyến tỉnh, bệnh viện đa khoa và bệnh viện thuộc khối công lập (hình 3). Trong đó, thành phố Hồ Chí Minh và thành phố Hà Nội có tỷ lệ báo cáo cao nhất chiếm tỷ lệ tương ứng 20,1% và 17,3% tổng số báo cáo của tất cả các cơ sở khám, chữa bệnh. Thành phố Đà Nẵng là địa phương có công tác báo cáo ADR hiệu quả nhất với số báo cáo/1 triệu dân đạt 669,9 báo cáo/1 triệu dân (hình 4). Các đơn vị có số lượng báo cáo ADR cao tập trung tại TP. Hồ Chí Minh và Hà Nội, trong đó Bệnh viện Bạch Mai là đơn vị có số báo cáo ADR nhiều nhất trong cả nước, chiếm 3,1% tổng số báo cáo ADR từ các đơn vị khám, chữa bệnh (bảng 3).
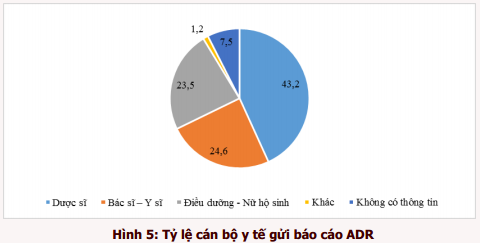
Cán bộ y tế gửi báo cáo chủ yếu là dược sĩ (43,2%), bác sĩ - y sĩ (24,6%) và tiếp theo là điều dưỡng và nữ hộ sinh (23,5%) (hình 5).
2. Các thuốc nghi ngờ gây ADR được báo cáo nhiều nhất
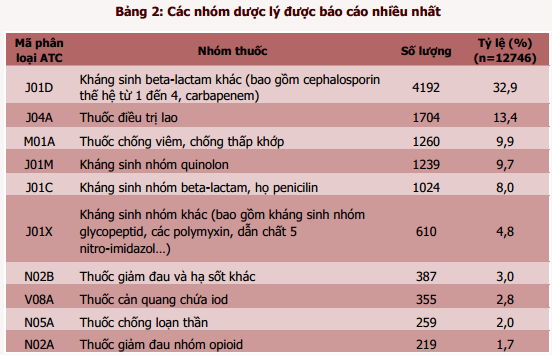
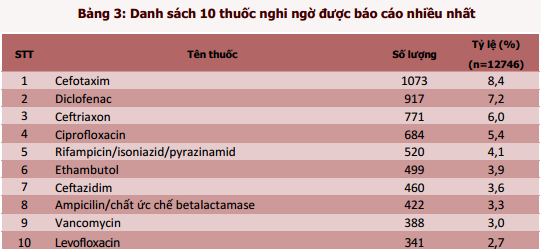
Trong 12812 báo cáo có 63 báo cáo về chất lượng thuốc và 3 báo cáo loại khác, do đó thông tin về thuốc nghi ngờ được thống kê trên 12746 báo cáo, tương ứng với 15618 thuốc nghi ngờ (tỷ lệ 1,23 thuốc/1 báo cáo). Các thuốc nghi ngờ gây phản ứng có hại xuất hiện nhiều nhất trong các báo cáo ADR thuộc 3 nhóm chính: nhóm thuốc kháng sinh nhiều nhất với các đại diện là cefotaxim, ciprofloxacin, ceftriaxon, ceftazidim, ampicilin/chất ức chế betalactamase, levofloxacin và vancomycin; nhóm thuốc điều trị lao (ethambutol, rifampicin/isoniazid/pyrazinamid), nhóm thuốc giảm đau, hạ sốt, chống viêm (diclofenac). Cefotaxim vẫn là thuốc nghi ngờ gây ra ADR được báo cáo nhiều nhất với tỷ lệ 8,4%.
II. BÁO CÁO ADR TỪ CÁC ĐƠN VỊ SẢN XUẤT, KINH DOANH DƯỢC PHẨM
Trong năm 2019, 45 đơn vị sản xuất và kinh doanh dược phẩm đã gửi báo cáo ADR đơn lẻ, 51 đơn vị sản xuất và kinh doanh dược phẩm đã gửi báo cáo tổng hợp định kỳ về Trung tâm DI & ADR Quốc gia và Trung tâm DI & ADR khu vực TP. Hồ Chí Minh.
Tổng số báo cáo ADR xảy ra tại Việt Nam đã được các đơn vị sản xuất, kinh doanh dược phẩm ghi nhận là 1715. Trong đó, VPĐD Hoffmann La Roche Ltd có số lượng báo cáo nhiều nhất (21,2%). Các chế phẩm đang được lưu hành trên thị trường được báo cáo nhiều nhất là erlotinib (9.5%), sorafenib (6,1%), dung dịch thẩm phân màng bụng (4,3%).
III. BÁO CÁO ADR TỪ NGHIÊN CỨU THỬ NGHIỆM LÂM SÀNG
Ngày 29/10/2018, Bộ Y tế đã ban hành Thông tư số 29/2018/TT-BYT Quy định về thử thuốc trên lâm sàng, có hiệu lực thi hành từ ngày 01/01/2019. Thông tư này quy định việc ban hành, áp dụng Thực hành tốt thử thuốc trên lâm sàng; đánh giá việc đáp ứng Thực hành tốt thử thuốc trên lâm sàng và hồ sơ, quy trình thử thuốc trên lâm sàng.
Theo Thực hành tốt thử thuốc trên lâm sàng được ban hành kèm theo Thông tư số 29/2018/TT-BYT, Trung tâm Quốc gia về Thông tin thuốc và Theo dõi phản ứng có hại của thuốc tiếp nhận báo cáo SAE trong nghiên cứu thử thuốc trên lâm sàng; phối hợp với Hội đồng đạo đức trong nghiên cứu y sinh học quốc gia để xem xét, đánh giá báo cáo SAE; thống kê, phân tích dữ liệu các báo cáo SAE trong các nghiên cứu thử thuốc trên lâm sàng; báo cáo, tư vấn, đề xuất cơ quan quản lý có thẩm quyền những nội dung liên quan đến bảo đảm an toàn cho người tham gia thử thuốc. Trước đó, vai trò của Trung tâm DI & ADR Quốc gia trong hoạt động giám sát biến cố bất lợi xảy ra trong nghiên cứu thử nghiệm lâm sàng cũng đã được ghi nhận trong Hướng dẫn về ghi nhận, xử trí và báo cáo các biến cố bất lợi, biến cố bất lợi nghiêm trọng trong nghiên cứu thử nghiệm lâm sàng tại Việt Nam (kèm theo Quyết định số 62/QĐ-K2ĐT ngày 02/6/2017 của Cục Khoa học Công nghệ và Đào tạo - Bộ Y tế).
Cũng theo Thực hành tốt thử thuốc trên lâm sàng được ban hành kèm theo Thông tư số 29/2018/TT-BYT, một trong những tiêu chuẩn chuyên môn của nghiên cứu viên và nghiên cứu viên chính là có Giấy chứng nhận hoàn thành khóa học báo cáo an toàn trong thử thuốc trên lâm sàng theo GCP do Bộ Y tế cấp hoặc cơ sở có chức năng đào tạo về báo cáo an toàn trong thử thuốc trên lâm sàng cấp, cập nhật định kỳ 03 năm một lần.
Năm 2019, Trung tâm DI & ADR Quốc gia đã nhận được 1898 báo cáo biến cố bất lợi nghiêm trọng xảy ra trong 82 nghiên cứu thử nghiệm lâm sàng tại Việt Nam.
IV. CÁC TRƯỜNG HỢP KHẨN LIÊN QUAN ĐẾN AN TOÀN THUỐC
Trong năm 2019, Trung tâm DI & ADR Quốc gia đã giải quyết 73 trường hợp khẩn bao gồm 41 trường hợp báo cáo ADR khẩn phản hồi cho đơn vị gửi báo cáo ADR và 32 trường hợp công văn cung cấp thông tin về an toàn thuốc cho cơ quan quản lý của Bộ Y tế. Trong các trường hợp báo cáo ADR khẩn, có 35 trường hợp tử vong và 06 chuỗi báo cáo. Song song với công tác phản hồi khẩn cho cá nhân, đơn vị gửi báo cáo ADR, Trung tâm DI & ADR Quốc gia cũng cập nhật các thông tin về an toàn thuốc gửi cơ quan quản lý của Bộ Y tế. Tính đến hết ngày 31/10/2019, tổng số công văn đã gửi là 32 công văn, trong đó, có 5 vấn đề đã được Cục Quản lý Dược cung cấp thông tin đến các cán bộ y tế bao gồm:
- Cung cấp thông tin quản lý của sản phẩm Pneumorel (fenspirid).
- Phản ứng có hại nghi ngờ do phenformin trong chế phẩm "Tiểu đường hoàn".
- Cung cấp thông tin về báo cáo ADR liên quan đến Rabeloc dùng đường tiêm truyền tĩnh mạch.
- Cung cấp thông tin về an toàn, hiệu quả và tình hình lưu hành của thuốc chứa mephenesin.
- Cung cấp thông tin về việc phát hiện tạp chất NDMA trong chế phẩm chứa ranitidin.
V. MỘT SỐ VẤN ĐỀ PHẢN ỨNG CÓ HẠI CỦA THUỐC CẦN LƯU Ý
Trong năm 2019, bên cạnh các phản ứng có hại thường gặp, dễ ghi nhận và phát hiện thông qua triệu chứng lâm sàng phản ứng trên da nghiêm trọng và phản ứng toàn thân (phản vệ/sốc phản vệ), một số phản ứng có hại phát hiện thông qua xét nghiệm cận lâm sàng và phản ứng có hại điển hình (typ A, tác dụng phụ) của một số thuốc cũng đã được ghi nhận như:
- Độc tính trên huyết học liên quan đến vancomycin.
- Chảy máu liên quan đến thuốc chống đông (enoxaparin, clopidogrel, aspirin).
- Ngộ độc thuốc gây tê.
- Rối loạn tâm thần liên quan đến kháng sinh quinolon (moxifloxacin, levofloxacin).
Trong đó, một số vấn đề đã được đề cập trong Bản tin Cảnh giác Dược. Cán bộ y tế có thể tham khảo các bài viết chi tiết tại Bản tin Cảnh giác Dược trực tuyến (http://magazine.canhgiacduoc.org.vn). Với vấn đề ngộ độc liên quan đến việc sử dụng thuốc gây tê, cán bộ y tế có thể tham khảo thêm bài viết “Ngộ độc thuốc gây tê” đã được đăng trên Bản tin Cảnh giác Dược số 1-2019. Với các vấn đề khác chưa được đề cập, Trung tâm DI & ADR Quốc gia sẽ tiếp tục tổng hợp trong các số Bản tin Cảnh giác Dược tiếp theo. Hy vọng Bản tin Cảnh giác Dược sẽ tiếp tục là nguồn cũng cấp thông tin thuốc và cảnh giác dược hữu ích cho cán bộ y tế.
VI. KẾT LUẬN VÀ ĐỀ XUẤT
Trong năm 2019, số lượng báo cáo ADR được Trung tâm DI & ADR Quốc gia và Trung tâm DI & ADR khu vực TP. Hồ Chí Minh tiếp nhận tăng 18,8% so với năm 2018. Tỷ lệ báo cáo vẫn chưa đồng đều giữa các địa phương, khu vực và các tuyến bệnh viện. Do đó, công tác báo cáo ADR cần tiếp tục được thúc đẩy hơn nữa, đặc biệt tại đơn vị, địa phương chưa tham gia báo cáo ADR. Bên cạnh các ADR rối loạn toàn thân và biểu hiện trên da, các ADR liên quan đến thuốc kháng sinh, thuốc chống lao, thuốc giảm đau chống viêm không steroid (NSAID), cán bộ y tế cũng cần chú ý theo dõi, phát hiện và báo cáo các biến cố bất lợi của các nhóm thuốc khác (đặc biệt các nhóm thuốc có nguy cơ cao gây ADR, thuốc có phạm vi điều trị hẹp), các ADR trên các hệ cơ quan khác, các biến cố bất lợi cần giám sát thông qua các thăm dò chức năng chuyên sâu hay xét nghiệm cận lâm sàng.
Trong quá trình xử lý báo cáo ADR, Trung tâm nhận thấy có một số báo cáo ADR gửi từ các đơn vị và thư cảm ơn, phản hồi từ Trung tâm bị thất lạc qua đường bưu điện. Để đảm bảo việc trao đổi thông tin được đầy đủ, kịp thời, Trung tâm xin đề nghị các đơn vị tăng cường triển khai báo cáo bằng các hình thức khác (báo cáo trực tuyến, gửi thư điện tử hoặc fax) bên cạnh hình thức gửi báo cáo qua đường bưu điện về Trung tâm. Hiện tại, Trung tâm đang triển khai gửi thư cảm ơn, phản hồi và các thông tin khác về ADR cho các đơn vị qua đường thư điện tử. Trong trường hợp có nhu cầu, đề nghị các đơn vị gửi công văn đề xuất 01 cán bộ đầu mối và 01 lãnh đạo khoa/phòng phụ trách công tác cảnh giác dược để nhận các thông tin nêu trên (công văn cần ghi rõ họ tên, chức vụ, đơn vị, số điện thoại và địa chỉ email của các cá nhân được đề xuất).
Trung tâm DI & ADR Quốc gia xin trân trọng cảm ơn sự hợp tác của các đơn vị và cán bộ y tế đã tham gia báo cáo ADR và mong muốn tiếp tục nhận được sự phối hợp để triển khai hiệu quả hoạt động giám sát ADR.

