
Nội dung bài
N-nitrosodimethylamine (NDMA) và N-nitrosodiethylamine (NDEA) là các dẫn chất nitrosamin được phân loại vào nhóm các chất có thể gây ung thư trên người. Tạp chất này được phát hiện lần đầu trong các thuốc thành phẩm chứa valsartan có nguyên liệu được sản xuất bởi Công ty Zhejiang Huahai Pharmaceuticals (ZHP), Linhai, Trung Quốc. Từ đó, hàng loạt lô thuốc valsartan có nguyên liệu được sản xuất tại đây đã bị thu hồi tại nhiều quốc gia trên thế giới cũng như ở Việt Nam [1], [2].
Việc xuất hiện NDMA và NDEA trong thuốc thành phẩm valsartan được cho rằng có liên quan đến một số giai đoạn nhất định trong quy trình sản xuất nguyên liệu của ZHP. Năm 2012, ZHP đã tiến hành một số thay đổi trong quy trình tổng hợp vòng tetrazol trong công thức của valsartan để tăng hiệu suất sản xuất, nhưng lại dẫn đến hình thành tạp chất NDMA. Tương tự, trong một số điều kiện phản ứng nhất định, tạp chất NDEA cũng có thể được hình thành. Tetrazol là cấu trúc phổ biến trong công thức hóa học của các hoạt chất thuốc ức chế thụ thể AT1. Vì vậy, không chỉ riêng valsartan, các thuốc khác trong nhóm này như candesartan, irbesartan, losartan và olmesartan có cấu trúc vòng tetrazol cũng được đưa vào rà soát. Sau đó, một số lô thuốc valsartan, losartan và irbesartan từ các nhà sản xuất khác nhau bị phát hiện nhiễm tạp chất đã bị thu hồi [2]. Không chỉ NDMA và NDEA, việc rà soát losartan tại Hoa Kỳ còn phát hiện thêm một tạp chất mới là N-nitroso-N-methyl-4-aminobutyric acid (NMBA). Tạp chất này cũng là một dẫn chất nitrosamin có nguy cơ gây ung thư tương tự NDMA [3].
Cơ quan Quản lý Dược phẩm châu Âu (EMA) đã ước tính nguy cơ mắc ung thư liên quan đến các tạp chất NDMA và NDEA dựa trên dữ liệu ngoại suy từ động vật. Nếu 100.000 bệnh nhân sử dụng valsartan được sản xuất bởi ZHP hàng ngày trong vòng 6 năm ở liều cao nhất (320 mg/ngày) thì phát sinh thêm 22 trường hợp ung thư do NDMA. Còn NDEA có thể dẫn đến có thêm 8 trường hợp ung thư khi sử dụng thuốc này ở liều cao nhất trong 4 năm. Cơ quan Quản lý Thuốc và Thực phẩm Hoa Kỳ (FDA Hoa Kỳ) cũng ước tính, khi sử dụng valsartan ở mức liều 320 mg/ngày trong vòng 4 năm, nguy cơ phát sinh thêm ca ung thư mới là 1/8000 bệnh nhân phơi nhiễm.
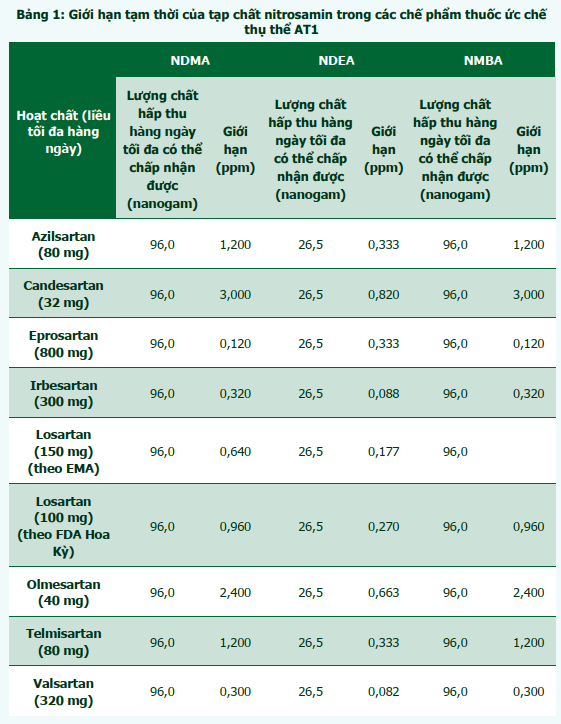
Để giảm thiểu nguy cơ cho bệnh nhân, các Cơ quan Quản lý Dược phẩm trên thế giới khuyến cáo các nhà sản xuất nên tự nguyện thu hồi thuốc nếu phát hiện thuốc thành phẩm nhiễm tạp chất nitrosamin. Tuy nhiên, để tránh tình trạng thiếu thuốc, các Cơ quan Quản lý đã đưa ra đồng thuận về giới hạn tạm thời tối đa cho phép với các chất NDMA và NDEA. Riêng FDA Hoa Kỳ có thêm giới hạn cho NMBA. Các giới hạn này được tính toán dựa trên lượng chất tối đa hấp thu hàng ngày có thể chấp nhận được với mỗi tạp chất: 96 nanogam với NDMA, 26,5 nanogam với NDEA và 96 nanogam với NMBA. Số liệu này sau đó được chia cho liều tối đa hàng ngày của mỗi hoạt chất để đưa ra mức giới hạn theo đơn vị ppm (1 ppm = 1/1.000.000). Giới hạn tạm thời cho các tạp chất nitrosamin cho các sản phẩm thuốc ức chế thụ thể AT1 được trình bày trong bảng 1 [3], [4]. Các sản phẩm có nồng độ tạp chất vượt quá giới hạn trên sẽ tiếp tục bị thu hồi. Cần lưu ý, đây chỉ là các mức giới hạn tạm thời trong thời gian cho phép các công ty tiến hành thay đổi quy trình sản xuất và có các biện pháp kiểm nghiệm nhằm phát hiện hàm lượng tạp chất thấp nhất, tiến tới mục tiêu loại bỏ hoàn toàn các tạp chất nitrosamin trong sản phẩm thuốc.
Hiện nay, các Cơ quan Quản lý Dược phẩm trên thế giới vẫn đang tiếp tục mở rộng rà soát đến cả các thuốc khác sau bài học về nhiễm tạp NDMA và NDEA từ các thuốc chẹn thụ thể AT1 vượt quá giới hạn cho phép. Gần đây, một số lô thuốc chứa ranitidin đã bị thu hồi do nguyên nhân này từ nhiều Cơ quan Quản lý Dược phẩm trên thế giới như Singapore, Úc, Hoa Kỳ, … Giới hạn cho phép của tạp chất NDMA theo giới hạn chấp nhận quy định tại ICH M7; cụ thể: Giới hạn tạm thời chấp nhận không quá 0,32 ppm (tính trên liều chấp nhận tối đa của NDMA là 96 nanogam/ngày và liều sử dụng tối đa của ranitidin là 300 mg/ngày). Tại Việt Nam, Cục Quản lý Dược cũng đã có công văn số 16813/QLD-CL và 16814/QLD-CL ngày 02/10/2019 thông báo tăng cường kiểm tra, kiểm soát chất lượng nguyên liệu và thuốc thành phẩm chứa ranitidine, đồng thời, thu hồi một số thuốc chứa ranitidin nhiễm tạp chất [5].
Các Cơ quan Quản lý Dược phẩm trên thế giới và tại Việt Nam đang rất nỗ lực, với những biện pháp tích cực rà soát, phát hiện các thuốc chứa tạp chất NDMA và NDEA để cung cấp thông tin đến cộng đồng. Tuy nhiên, cũng cần lưu ý, không phải toàn bộ các thuốc chứa ranitidin hay các thuốc “sartan” trên thị trường đều nhiễm tạp chất này [6], [7], [8].
Tổng hợp khuyến cáo dành cho cán bộ y tế và cho người bệnh từ các Cơ quan Quản lý Dược phẩm trên thế giới đến thời điểm hiện tại như sau:
Thông tin dành cho người bệnh [6], [7], [8], [9] :
- Bệnh nhân đang sử dụng thuốc thuốc nhóm "sartan" hoặc ranitidin nên kiểm tra thuốc của mình có nằm trong danh sách các sản phẩm bị thu hồi hay không.
- Nguy cơ gây hại tiềm tàng của tạp chất nhóm nitrosamin liên quan đến sử dụng thuốc trong thời gian dài, do đó bệnh nhân được kê đơn dùng ngắn hạn các thuốc bị ảnh hưởng có thể tiếp tục sử dụng thuốc.
- Các bệnh nhân sử dụng các thuốc nhóm "sartan" hoặc thuốc ranitidin theo đơn, bao gồm cả sản phẩm bị thu hồi, không nên tự ý ngừng sử dụng thuốc. Bệnh nhân cần trao đổi với bác sĩ điều trị và thống nhất phương án điều trị thay thế, vì nguy cơ do ngừng điều trị đột ngột có thể lớn hơn rủi ro liên quan đến phơi nhiễm NDMA.
- Bệnh nhân dùng chế phẩm chứa thuốc nhóm "sartan" hoặc ranitidin theo đơn thuốc nhưng muốn ngừng thuốc nên trao đổi với cán bộ y tế về dùng lựa chọn điều trị thay thế. Có một số thuốc được phê duyệt với chỉ định tương tự các thuốc này và có thể thay thế được cho các thuốc này. Người bệnh dùng chế phẩm chứa ranitidin không kê đơn có thể cân nhắc sử dụng các sản phẩm không kê đơn khác thay thế nếu phù hợp.
- Trong khi các cơ quan quản lý đang điều tra nguyên nhân hàm lượng tạp chất NDMA cao hơn giới hạn cho phép và nguy cơ gây hại cho người bệnh, người sử dụng và bệnh nhân có thể tiếp tục dùng các chế phẩm chứa thuốc nhóm "sartan" và ranitidin không bị thu hồi. Lưu ý quan trọng cần nhớ là không phải tất cả các thuốc chứa "sartan" và ranitidin trên thị trường đều bị thu hồi.
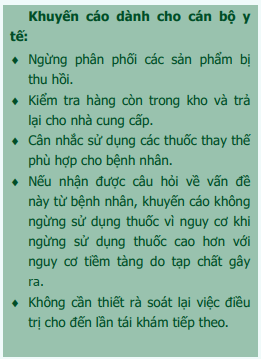
Thông tin dành cho cán bộ y tế [8], [9], [10]:
Nồng độ chấp nhận được của nitrosamin được tính theo đơn vị nanogam (ng). Giá trị này được coi là an toàn nếu bệnh nhân dùng thuốc hàng ngày đến 70 năm. Cho đến nay, hàm lượng NDMA được phát hiện trong các thuốc nhóm "sartan" và ranitidin, nếu dùng trong nhiều thập kỷ, có thể làm tăng nhẹ nguy cơ ung thư cho từng cá thể người bệnh. Hàm lượng ở mức độ chấp nhận được bắt nguồn từ các nghiên cứu gây ung thư trên động vật kết hợp với mức độ an toàn cao, tuy nhiên không thể đưa ra một con số chính xác ước tính mức độ rủi ro gây ung thư liên quan đến tạp chất NDMA dựa vào dữ liệu an toàn hiện có. Mặc dù nguy cơ bổ sung do tạp chất NDMA trong "sartan" và ranitidin ở các nồng độ xác định cho đến nay là thấp, với các bệnh nhân đang sử dụng thuốc chứa tạp chất NDMA, nguy cơ trên có thể vượt trội hơn lợi ích khi sử dụng thuốc.
Tài liệu tham khảo
1. Cục Quản lý Dược, Công văn số 14487/QLD-CL về việc xử lý thuốc chứa dược chất valsartan, ngày 26/7/2018.
2. Charoo NA et al (2019), “Lesson Learnt from Recall of Valsartan and Other Angiotensin II Receptor Blocker Drugs Containing NDMA and NDEA Impurities”, AAPS PharmSciTech 2019 Apr 15;20(5):166. doi: 10.1208/s12249-019-1376-1.
3. FDA (2019), “FDA updates table of interim limits for nitrosamine impurities in ARBs”, accessed on 8/10/2019.
4. EMA (2019), “Sartan medicines: companies to review manufacturing processes to avoid presence of nitrosamine impurities”, accessed on 08/10/2019.
5. Cục Quản lý Dược, Công văn số 16813/QLD-CL về việc về việc phát hiện thuốc chứa Ranitidine có chứa tạp chất NDMA vượt giới hạn cho phép, 16814/QLD-CL về việc về việc thu hồi thuốc chứa Ranitidine có chứa tạp chất NDMA vượt giới hạn cho phép, ngày 02/10/2019.
6. FDA (2019), “FDA announces voluntary recall of Sandoz ranitidine capsules following detection of an impurity”, dated 24/9/2019.
7. Health Canada (2019), “Health Canada requests that companies stop distributing ranitidine drugs in Canada while it assesses NDMA; additional products being recalled”, dated 26/9/2019.
8. EMA (2018), “EMA reviewing medicines containing valsartan from Zhejiang Huahai following detection of an impurity: some valsartan medicines being recalled across the EU”, dated 05/07/2018.
9. HSA (2019), “HSA Stops Supply of Eight Brands of Ranitidine Products in Singapore”, accessed on 08/10/2019.
10. TGA (2019), “Ranitidin-Update- contamination with N-nitrosodimethylamine”, dated 22/10/2019.

