
Nội dung bài
Trong 6 tháng (từ tháng 11/2018 đến hết tháng 4/2019), Trung tâm DI & ADR Quốc gia và Trung tâm DI & ADR khu vực TP. Hồ Chí Minh đã tiếp nhận 6094 báo cáo ADR (tăng 8% so với cùng kỳ năm 2018). Trong đó, 5467 báo cáo ADR được gửi từ các cơ sở khám, chữa bệnh và 639 báo cáo ADR xảy ra trên lãnh thổ Việt Nam từ các đơn vị sản xuất, kinh doanh dược phẩm (trong đó có 12 báo cáo trùng với báo cáo từ các cơ sở khám, chữa bệnh). Số lượng báo cáo ADR lũy tiến theo tháng được thể hiện trong hình 1. Số lượng báo cáo ADR không đồng đều giữa các tháng, trong đó số lượng báo cáo thấp nhất vào tháng 2 (713 báo cáo) và nhiều nhất vào tháng 4 (1257 báo cáo).
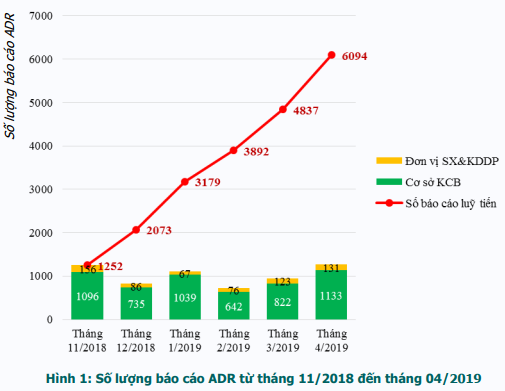
Báo cáo ADR từ các cơ sở khám, chữa bệnh
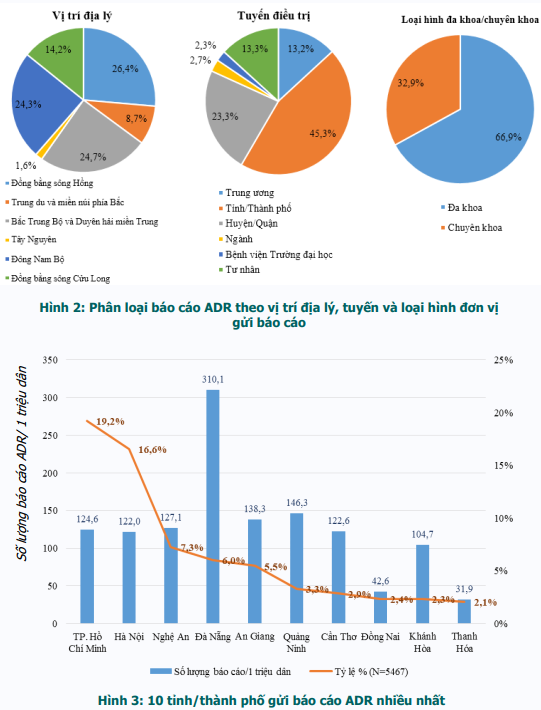
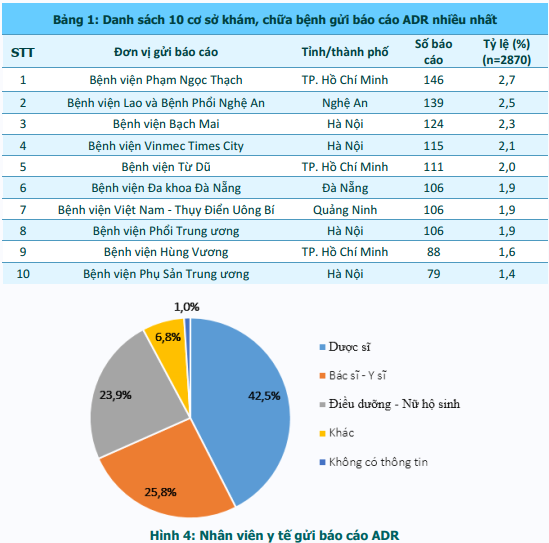
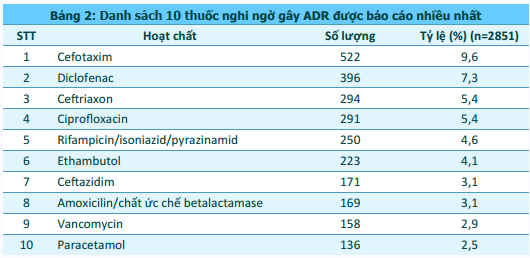
640 cơ sở khám bệnh, chữa bệnh của 63 tỉnh, thành phố trong cả nước đã gửi báo cáo ADR. Phần lớn báo cáo được gửi từ các đơn vị ở vùng Đồng bằng sông Hồng; Bắc Trung Bộ và Duyên hải miền Trung; và Đông Nam Bộ, từ các bệnh viện tuyến tỉnh, bệnh viện đa khoa và bệnh viện thuộc khối công lập (hình 2). Trong đó, thành phố Hồ Chí Minh và Hà Nội có số lượng báo cáo cao nhất (tương ứng 19,2% và 16,6% tổng số báo cáo nhận được của cả nước). Thành phố Đà Nẵng là những địa phương có công tác báo cáo ADR hiệu quả nhất với số báo cáo/1 triệu dân cao nhất trong cả nước (310,1 báo cáo/1 triệu dân) (hình 3). Các đơn vị có số lượng báo cáo ADR cao tập trung tại Hà Nội và TP. Hồ Chí Minh. Bệnh viện Phạm Ngọc Thạch và Bệnh viện Lao và Bệnh Phổi Nghệ An là hai đơn vị có số báo cáo ADR nhiều nhất trong cả nước, chiếm tương ứng 2,7% và 2,5% tổng số báo cáo ADR từ các đơn vị khám, chữa bệnh (bảng 1).
Cán bộ y tế tham gia gửi báo cáo chủ yếu là dược sĩ (42,5%), bác sĩ - y sĩ (25,8%) và tiếp theo là điều dưỡng và nữ hộ sinh (23,9%) (hình 4).
Trong số 5467 báo cáo, có 33 báo cáo về chất lượng thuốc và 01 báo cáo loại khác. Vì vậy, thông tin về thuốc nghi ngờ được thống kê trên 5433 báo cáo. Tổng số thuốc nghi ngờ được báo cáo là 6456 thuốc (tỷ lệ vẫn duy trì 1,19 thuốc/1 báo cáo). Phản ứng có hại xảy ra chủ yếu khi sử dụng thuốc theo đường tiêm/truyền tĩnh mạch (49,7%). Các thuốc nghi ngờ gây ADR được báo cáo thuộc 3 nhóm chính: kháng sinh (cefotaxim, ceftriaxon, ciprofloxacin, ceftazidim, amoxicilin/chất ức chế betalactamase và vancomycin), các thuốc điều trị lao (rifampicin/isoniazid/pyrazinamid và ethambutol), và thuốc giảm đau, chống viêm (diclofenac, paracetamol). Cefotaxim vẫn là thuốc nghi ngờ gây ra ADR được báo cáo nhiều nhất với tỷ lệ 9,6% (bảng 2).
Báo cáo ADR từ các đơn vị sản xuất, kinh doanh dược phẩm
Trong giai đoạn từ tháng 11/2018 đến tháng 4/2019, 26 đơn vị sản xuất và kinh doanh dược phẩm đã gửi báo cáo ca bệnh ADR và 32 đơn vị sản xuất và kinh doanh dược phẩm đã gửi báo cáo tổng hợp định kỳ về Trung tâm DI & ADR Quốc gia và Trung tâm DI & ADR khu vực TP. Hồ Chí Minh.
Tổng số báo cáo ADR xảy ra tại Việt Nam đã được các đơn vị sản xuất, kinh doanh dược phẩm ghi nhận là 639 báo cáo, trong đó có 288 báo cáo nghiêm trọng (chiếm 45,1%). Ngoài ra, các chế phẩm đang được lưu hành trên thị trường được báo cáo nhiều nhất bao gồm erlotinib (14,4%), sorafenib (9,1%), dung dịch thẩm phân màng bụng (8,3%) và imatinib (6,0%).
Báo cáo SAE từ các nghiên cứu thử nghiệm lâm sàng
Từ tháng 11/2018 đến hết tháng 4/2019, Trung tâm DI & ADR Quốc gia đã nhận được 892 báo cáo biến cố bất lợi nghiêm trọng (SAE) trong 64 nghiên cứu thử nghiệm lâm sàng được gửi đến từ 43 tổ chức nhận thử tại Việt Nam.
Kết luận
Như vậy, số lượng báo cáo ADR trong khoảng thời gian 6 tháng (từ tháng 11/2018 đến tháng 4/2019) vẫn có xu hướng tăng so với cùng kỳ năm 2018, tuy nhiên cơ cấu báo cáo ADR vẫn tương tự so với giai đoạn trước đó. Cụ thể, số lượng báo cáo không đồng đều giữa các địa phương, khu vực và các tuyến bệnh viện; dược sĩ là đối tượng chính tham gia báo cáo ADR. Bên cạnh việc báo cáo ADR của các thuốc được sử dụng nhiều (thuốc kháng sinh, thuốc điều trị lao, thuốc giảm đau, chống viêm) và các phản ứng có hại thông thường (dị ứng ngoài da, phản ứng phản vệ/sốc phản vệ), cán bộ y tế cần tập trung báo cáo phản ứng có hại của các thuốc mới được sử dụng tại đơn vị, phản ứng có hại mới chưa được ghi nhận và các phản ứng có hại cần xét nghiệm cận lâm sàng hoặc thăm dò chức năng chuyên biệt.
Trung tâm DI & ADR Quốc gia xin trân trọng cảm ơn sự hợp tác của các đơn vị và cán bộ y tế đã tham gia báo cáo ADR và mong muốn tiếp tục nhận được sự phối hợp để triển khai hiệu quả hoạt động giám sát ADR.

