
Nội dung bài
Trong khoảng thời gian từ tháng 11/2017 đến hết tháng 01/2018, Trung tâm DI & ADR Quốc gia và Trung tâm DI & ADR khu vực TP. Hồ Chí Minh đã tiếp nhận 3323 báo cáo ADR (tương ứng với 34,3% tổng số báo cáo năm 2017). Trong đó, 2885 báo cáo ADR được gửi từ các cơ sở khám, chữa bệnh và 445 báo cáo ADR xảy ra trên lãnh thổ Việt Nam từ các đơn vị sản xuất, kinh doanh dược phẩm (có 7 báo cáo trùng với báo cáo từ các cơ sở khám, chữa bệnh). Số lượng báo cáo ADR lũy tiến theo tháng được thể hiện trong hình 1. Số lượng báo cáo ADR ghi nhận qua từng tháng khá đồng đều.
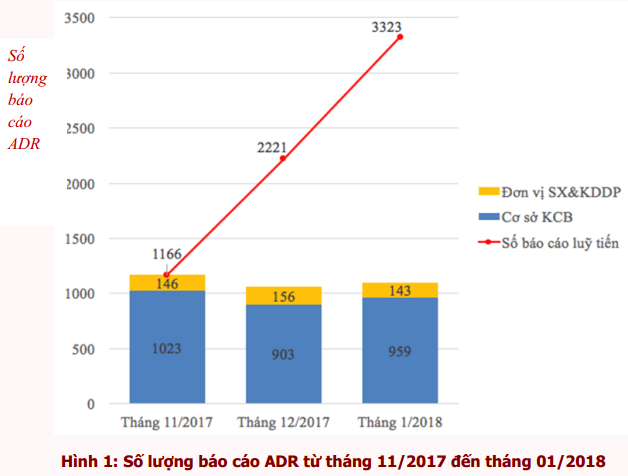
Báo cáo ADR từ các cơ sở khám bệnh, chữa bệnh
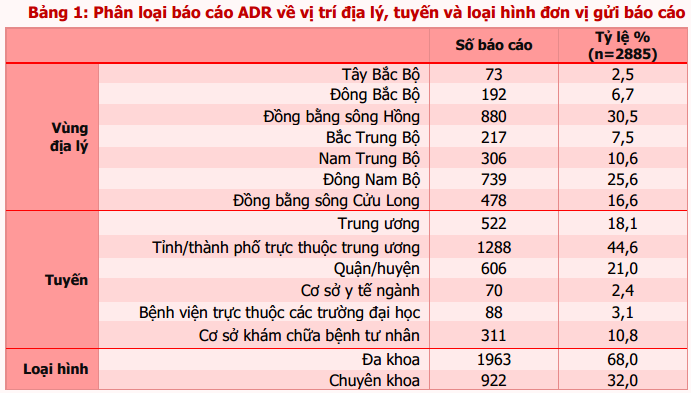
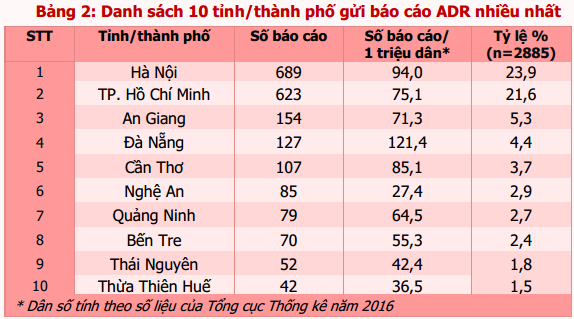
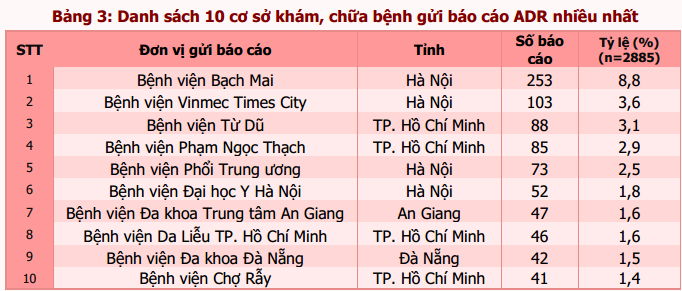
Tính đến hết ngày 31/01/2018, 449 cơ sở khám bệnh, chữa bệnh của 62 tỉnh, thành phố trong cả nước đã gửi báo cáo ADR. Tuyên Quang là tỉnh chưa tham gia báo cáo ADR trong giai đoạn này. Phần lớn báo cáo vẫn được gửi từ các đơn vị ở vùng đồng bằng sông Hồng và Đông Nam bộ, từ các bệnh viện tuyến tỉnh, bệnh viện đa khoa và bệnh viện thuộc khối công lập (bảng 1). Trong đó, Hà Nội và thành phố Hồ Chí Minh có số lượng báo cáo cao nhất (tương ứng 23,9% và 21,6% tổng số báo cáo nhận được của cả nước). Thành phố Đà Nẵng là địa phương có công tác báo cáo ADR hiệu quả nhất với số báo cáo/1 triệu dân cao nhất trong cả nước (121,4 báo cáo/1 triệu dân) (bảng 2). Các đơn vị có số lượng báo cáo ADR cao tập trung tại TP. Hồ Chí Minh và Hà Nội. Bệnh viện Bạch Mai là đơn vị có số báo cáo ADR nhiều nhất trong cả nước, chiếm 8,8% tổng số báo cáo ADR từ các cơ sở khám, chữa bệnh (bảng 3). Ngoài ra, bệnh viện Vinmec Times City là bệnh viện tư nhân có số lượng báo cáo nhiều nhất, là cơ sở khám, chữa bệnh ghi nhận báo cáo ADR chỉ sau Bệnh viện Bạch Mai (chiếm 3,6%).
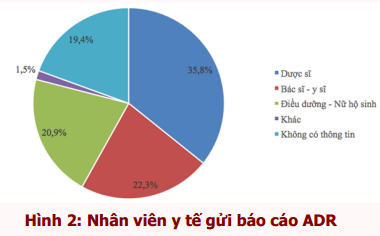
Đối tượng gửi báo cáo chủ yếu là dược sĩ (35,8%), bác sĩ - y sĩ (22,3%) và điều dưỡng và nữ hộ sinh (20,9%) (hình 2).
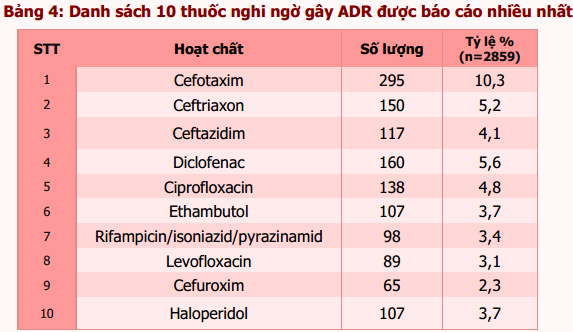
Trong số 2885 báo cáo có 26 báo cáo về chất lượng thuốc. Vì vậy, thông tin về thuốc nghi ngờ được thống kê trên 2859 báo cáo. Tổng số thuốc nghi ngờ được báo cáo là 3730 thuốc (tỷ lệ vẫn duy trì 1,3 thuốc/1 báo cáo). Các thuốc nghi ngờ gây ADR được báo cáo thuộc 4 nhóm chính: kháng sinh (cefotaxim, ceftriaxon, ceftazidim, ciprofloxacin, levofloxacin và cefuroxim), thuốc điều trị lao (ethambutol và rifampicin/isoniazid/pyrazinamid), thuốc giảm đau, chống viêm (diclofenac) và thuốc chống loạn thần (haloperidol). Cefotaxim vẫn là thuốc nghi ngờ gây ra ADR được báo cáo nhiều nhất với tỷ lệ 10,3% (bảng 4).
Báo cáo ADR từ các đơn vị sản xuất, kinh doanh dược phẩm
Trong giai đoạn từ tháng 11/2017 – tháng 01/2018, 20 đơn vị sản xuất và kinh doanh dược phẩm đã gửi báo cáo ADR đơn lẻ và 26 đơn vị sản xuất và kinh doanh dược phẩm đã gửi báo cáo tổng hợp định kỳ về Trung tâm DI & ADR Quốc gia và Trung tâm DI & ADR khu vực TP. Hồ Chí Minh.
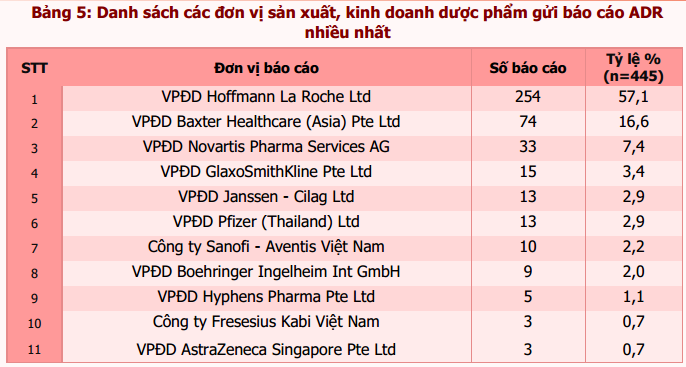
Tổng số báo cáo ADR xảy ra tại Việt Nam đã được các đơn vị sản xuất, kinh doanh dược phẩm ghi nhận là 445 (trong đó có 7 báo cáo trùng với báo cáo từ các cơ sở khám, chữa bệnh). Các đơn vị sản xuất, kinh doanh dược phẩm tích cực tham gia báo cáo ADR được tổng hợp trong bảng 5. Ngoài ra, các chế phẩm đang được lưu hành trên thị trường được báo cáo nhiều nhất là erlotinib (36,6%), dung dịch thẩm phân màng bụng (16,4%), bevacizumab (6,3%), capecitabin (5,2%) và imatinib (4,7%).
Báo cáo biến cố bất lợi nghiêm trọng (SAE) từ các nghiên cứu thử nghiệm lâm sàng
Từ tháng 11/2017 đến tháng 01/2018, Trung tâm DI & ADR Quốc gia đã nhận được 423 báo cáo biến cố bất lợi nghiêm trọng trong 41 nghiên cứu thử nghiệm lâm sàng được gửi đến từ 45 tổ chức nhận thử tại Việt Nam.
Kết luận
Trong giai đoạn từ tháng 11/2017 đến tháng 01/2018, số lượng báo cáo ADR được tiếp nhận là 3323 (tương ứng với 34,3% tổng số báo cáo năm 2017). Số lượng báo cáo ghi nhận khá đồng đều theo tháng tuy nhiên tỷ lệ này vẫn chưa đồng đều giữa các địa phương, khu vực và các tuyến bệnh viện. Do đó, công tác báo cáo ADR cần tiếp tục được thúc đẩy hơn nữa, đặc biệt tại đơn vị, địa phương chưa tham gia báo cáo ADR. Dược sĩ là đối tượng chính tham gia báo cáo ADR và cần tiếp tục phát huy hơn nữa vai trò của mình trong công tác đảm bảo an toàn thuốc nói chung và hoạt động theo dõi, báo cáo ADR nói riêng. Bên cạnh việc báo cáo ADR của các thuốc được sử dụng nhiều (thuốc kháng sinh, thuốc điều trị lao, thuốc giảm đau, chống viêm) và các phản ứng có hại thông thường (dị ứng ngoài da, phản ứng phản vệ/sốc phản vệ), cán bộ y tế cần tập trung báo cáo phản ứng có hại của các thuốc mới được sử dụng tại đơn vị, phản ứng có hại mới chưa được ghi nhận và các phản ứng có hại cần xét nghiệm cận lâm sàng hoặc thăm dò chức năng chuyên biệt.
Trung tâm DI & ADR Quốc gia xin trân trọng cảm ơn sự hợp tác của các đơn vị và cán bộ y tế đã tham gia báo cáo ADR và mong muốn tiếp tục nhận được sự phối hợp để triển khai hiệu quả hoạt động giám sát ADR. Bên cạnh đó, để phục vụ công tác kiểm tra, đánh giá chất lượng bệnh viện, từ năm 2018, Trung tâm DI & ADR Quốc gia sẽ tổng kết công tác báo cáo ADR từ tháng 11 năm trước đến hết tháng 10 của năm kế tiếp. Trong đó, dữ liệu tổng kết sẽ được tổng hợp định kỳ 3 tháng/lần để cập nhật thông tin thường xuyên đến nhân viên y tế thông qua Bản tin Cảnh giác Dược.

