
Tóm tắt
Nội dung bài
Phân nhóm dược lý và một số chỉ định của các thuốc này được trình bày trong bảng 1.
Bảng 1: Phân nhóm dược lý và chỉ định thường gặp của eperison, drotaverin và glutathion [1], [2], [3]
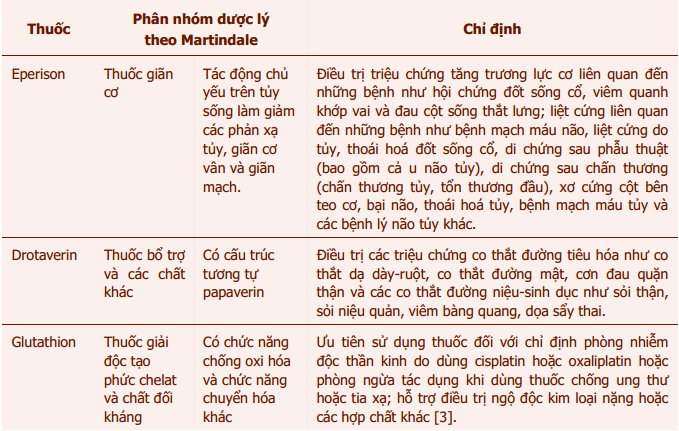
Tại hầu hết các nước được coi là tham chiếu trong đăng ký thuốc theo Thông tư 44/2014/TT-BYT (ví dụ như Anh, Pháp, Đức, Úc, Canada, Mỹ, và Châu Âu), eperison, drotaverin và glutathionchưa chính thức có mặt trong danh mục thuốc được sử dụng trong điều trị lâm sàng. Các thuốc trênchủ yếu được lưu hành tại các nước Châu Á như Trung Quốc, Nhật Bản, Ấn Độ, Singapore, Thái Lan, Malaysia, …[1]. Tại Việt Nam, cả ba thuốc đều nằm trong Danh mục thuốc tân dược thuộc phạm vi thanh toán của quỹ bảo hiểm y tế [2], [4]. Do không được sử dụng rộng rãi tại nhiều nước phát triển nên dữ liệu về các phản ứng có hại (ADR) của eperison, drotaverin và glutathiontrongy văn còn rất hạn chế (chi tiết xin xem bảng 2).
Bảng 2: Dữ liệu về ADR của eperison, drotaverin và glutathion ghi nhận trong y văn

Tại Việt Nam, những báo cáo về phản ứng quá mẫn nghiêm trọng như phản vệ/sốc phản vệ khi sử dụng eperison, drotaverin và glutathion cũng đã được ghi nhận. Trong năm 2016, Trung tâm DI & ADR Quốc gia đã ghi nhận:
+ Một trường hợp tử vong do sốc phản vệ có liên quan đến Myonal (eperison). Tuy nhiên, do bệnh nhân được sử dụng đồng thời eperison với một thuốc khác (esomeprazol) nên khó xác định chắc chắn eperison có là nguyên nhân gây phản ứng hay không.
+ Hai chuỗi báo cáo liên quan đến chế phẩm Vinopa (drotaverin) dạng dung dịch tiêm với các triệu chứng như quá mẫnngoài da, khó thở, lạnh run và phản vệ.
+ Một chuỗi gồm hai báo cáo về phản ứng quá mẫn trên da và sốc phản vệ liên quan đến glutathion.
Thông tin liên quan đếnbáo cáo phản vệ của eperison, drotaverin và glutathion được ghi nhận trong Cơ sở dữ liệu báo cáo ADRcủa Việt Nam và của Tổ chức Y tế Thế giới(WHO) được trình bày trong bảng 3.
Bảng 3:Thông tin về số lượng báo cáophản ứng phản vệ/sốc phản vệghi nhận tại Việt Nam và thế giới liên quan đến eperison, drotaverin và glutathion
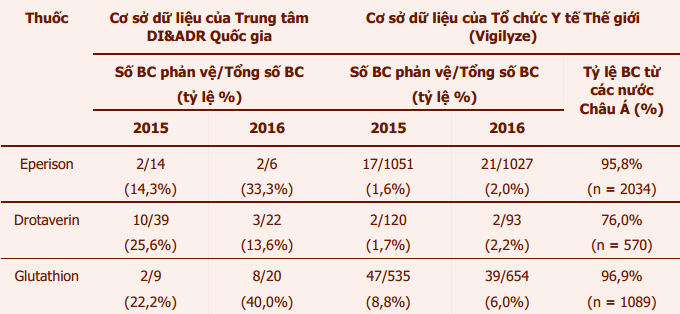
Để hạn chế phản ứng có hại liên quan tới ba thuốc này, cán bộ y tế cần chú ý chỉ kê đơn eperison, drotaverin và glutathion phù hợp với các chỉ định trong tờ Hướng dẫn sử dụng đã được Bộ Y tế phê duyệt hoặc các hướng dẫn điều trị hiện hành do Bộ Y tế phê duyệt. Phản ứng có hại nghiêm trọng có thể xảy ra với bất kỳ liều dùng và đường dùng nào của thuốc, đặc biệt là đường tĩnh mạch. Do vậy, cần theo dõi bệnh nhân sau khi tiêm thuốc ít nhất 30 phút để có thể xử trí kịp thời. Khi xảy ra phản ứng phản vệ/sốc phản vệ, cần thực hiện ngay theo phác đồ chống sốc hiện hành với adrenalin tiêm bắp, thở oxy, đặt nội khí quản, truyền dịch,thuốc kháng histamin, hít thuốc chủ vận beta-adrenergic, tiêm tĩnh mạch hydrocortison hoặc prednisolon nếu cần.Việc khai thác kỹ tiền sử dị ứng trước khi kê đơn và cảnh báo bệnh nhân không sử dụng lại thuốc nghi ngờ gây dị ứng cho bệnh nhân là biện pháp rất quan trọng để dự phòng các phản ứng quá mẫn có thể xảy ra.
Trong khi thông tin về hiệu quả và các phản ứng có hại của cả eperison, drotaverin và glutathion còn hạn chế, báo cáo tự nguyện là nguồn dữ liệu chủ yếu giúp đánh giá độ an toàn của thuốc. Bên cạnh những biện pháp hạn chế các phản ứng dị ứng liên quan đến eperison, drotaverin và glutathion, xin quý đồng nghiệp theo dõi, thu thập và gửi tất cả các báo cáo phản ứng dị ứng liên quan và gửi về Trung tâm DI&ADR Quốc gia để tăng cường dữ liệu đánh giá độ an toàn của các thuốc trên.
Tài liệu tham khảo
1. The Pharmaceutical Press (2017). Martindale: The Complete Drug Reference. Retrieved 12th Jan, 2017 fromhttps://medicine.canhgiacduoc.org.vn:2059/mc/martindale/current/index.htm.
2. Bộ Y Tế (2015).Dược thư Quốc gia Việt Nam, Lần xuất bản thứ hai, tr. 592, NXB Khoa học và kỹ thuật, Hà Nội.
3. Bảo hiểm xã hội Việt Nam (2012), Công văn số 2503/BHXH – DVT ngày 02/7/2012 về việc thanh toán theo chế độ BHYT đối với 5 loại thuốc.
4. Bộ Y Tế (2014). Danh mục thuốc thuộc phạm vi thanh toán của bảo hiểm y tế ban hành kèm theo Thông tư số 40 /TT-BYT ngày 17 tháng 11 năm 2014 của Bộ trưởng Bộ Y tế.
5. World Truven Health Analytics, Micromedex Solution -DrugDEX, Retrieved 10th Feb, 2017 from
6. S. Bavage, S. Durg, S.A. Kareem, S.B. Dhadde (2016). Clinical efficacy and safety of eperisone for low back pain: A systematic literature review. Pharmacological Reports 68, p.903-912.
7. Eisai Co., Ltd. (2012).Product Information.Retrieved 10th Feb, 2017 from http://www.shijiebiaopin.net/upload/product/201082521391314.pdf
8. Amitabh Dash, Rituparna Maiti et al (2012). Intramuscular Drotaverine and Diclofenac in Acute Renal Colic: A Comparative Study of Analgesic Efficacy and Safety. Pain Medicine, 13: 466–471
9. Ramesh R. Rai, Manisha Dwivedi et al (2014). Efficacy and Safety of Drotaverine Hydrochloride in Irritable Bowel Syndrome: A Randomized Double-Blind Placebo-Controlled Study. The Saudi Journal of Gastroenterology, 20 (6): 378-382.
10. Manishnarang, DheeraJshah, et al (2015). Efficacy and Safety of Drotaverine Hydrochloride in Children with Recurrent Abdominal Pain: A Randomized Placebo Controlled Trial. Indian Pediatrics, 52: 841-851.
11. J.J. Kavanagh, D.M. Gershenson, et al (2005). Multi-institutional phase 2 study of TLK286 (TELCYTA, a glutathione S-transferase P1-1 activated glutathione analog prodrug) in patients with platinum and paclitaxel refractory or resistant ovarian cancer, Int J Gynecol Cancer, 15, 593-600
12. Vergote I, Finkler N, del Campo J, et al (2009).Phase 3 randomised study of canfosfamide (Telcyta, TLK286) versus pegylated liposomal doxorubicin or topotecan as third-line therapy in patients with platinum-refractory or -resistant ovarian cancer. Eur J Cancer, 45(13):2324-32
13. Raza A, Galili N, Smith SE, et al (2012). A phase 2 randomized multicenter study of 2 extended dosing schedules of oral ezatiostat in low to intermediate-1 risk myelodysplastic syndrome. Cancer, 118(8):2138-47

