
Tóm tắt
Nội dung bài
I. BÁO CÁO ADR TỪ CÁC CƠ SỞ KHÁM, CHỮA BỆNH
1. Số lượng báo cáo đã tiếp nhận
Số lượng báo cáo ADR nhận được tính đến hết ngày 15/6/2013 từ các cơ sở khám chữa bệnh là 1987 báo cáo, tăng gần gấp 2 lần so với cùng kỳ năm 2012 (1048 báo cáo). Chi tiết số lượng báo cáo đã nhận được lũy tiến từ tháng 1 đến tháng 6 được trình bày trong hình 1.
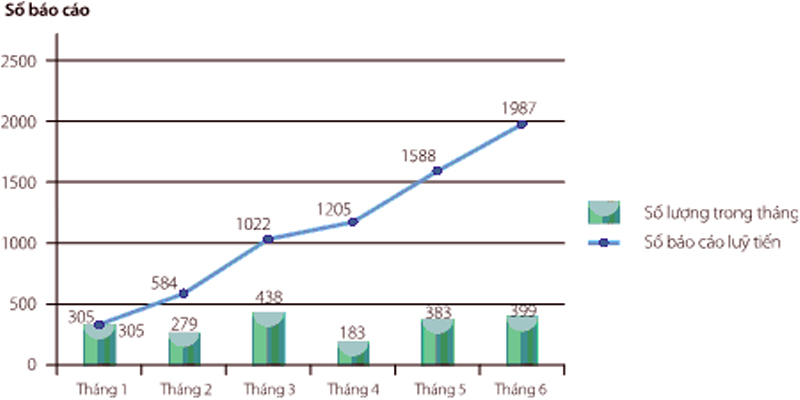
Hình 1: Số lượng báo cáo ADR tích lũy từ tháng 1 đến tháng 6 năm 2013
Như vậy, số lượng báo cáo ADR nhận được có thay đổi qua các tháng. Số lượng báo cáo thấp nhất vào tháng 4 (183 báo cáo) và nhiều nhất vào tháng 3 (438 báo cáo).
2. Tình hình báo cáo ADR từ các đơn vị
Tính đến hết quí II năm 2013, các cơ sở khám, chữa bệnh của 62/63 tỉnh, thành phố đã gửi báo cáo ADR. Tỉnh duy nhất chưa gửi báo cáo ADR là Phú Yên. Danh sách 10 cơ sở khám, chữa bệnh gửi báo cáo nhiều nhất trong tổng số 301 đơn vị đã gửi báo cáo ADR được trình bày trong bảng 1.
|
Bảng 1: Danh sách 10 bệnh viện gửi báo cáo ADR nhiều nhất |
||||
|
STT |
Tên Bệnh Viện |
Tỉnh/ thành phố |
Số báo cáo |
Tỷ lệ (%) |
|
1 |
Bệnh viện Bạch Mai |
Hà Nội |
165 |
8,30 |
|
2 |
Bệnh viện Phạm Ngọc Thạch |
TP. Hồ Chí Minh |
126 |
6,34 |
|
3 |
Bệnh viện Hùng Vương |
TP. Hồ Chí Minh |
78 |
3,93 |
|
4 |
Bệnh viện Đa khoa tỉnh Quảng Ninh |
Quảng Ninh |
72 |
3,62 |
|
6 |
Bệnh viện Da liễu TP. Hồ Chí Minh |
TP. Hồ Chí Minh |
46 |
2,32 |
|
5 |
Bệnh viện Phụ sản Trung ương |
Hà Nội |
46 |
2,32 |
|
7 |
Bệnh viện Nhân Dân Gia Định |
TP. Hồ Chí Minh |
41 |
2,06 |
|
8 |
Bệnh viện Từ Dũ |
TP. Hồ Chí Minh |
40 |
2,01 |
|
9 |
Bệnh viện Lao và Phổi Quảng Ninh |
Quảng Ninh |
31 |
1,56 |
|
10 |
Bệnh viện Nhi Đồng I |
TP. Hồ Chí Minh |
31 |
1,56 |
3. Các thuốc nghi ngờ gây ra ADR được báo cáo nhiều nhất
Trong 1987 báo cáo có 1 báo cáo về mỹ phẩm, 2 báo cáo về thuốc trừ sâu, do đó tổng số thuốc nghi ngờ được báo cáo được thống kê từ 1984 báo cáo ADR là 2486 thuốc (tỷ lệ 1,25 thuốc/1 báo cáo). Các thuốc nghi ngờ gây phản ứng có hại xuất hiện nhiều nhất trong các báo cáo ADR thuộc 4 nhóm chính: kháng sinh nhiều nhất với 4 hoạt chất là cefotaxim, ceftriaxon, ceftazidim, ciprofloxacin; thuốc điều trị lao (streptomycin, pyrazinamid, rifampicin); thuốc hạ sốt, giảm đau, chống viêm (paracetamol, diclofenac) và thuốc điều trị sốt rét (primaquin). Cefotaxim là thuốc được báo cáo nhiều nhất (11,17%) (bảng 2).
|
Bảng 2: Danh sách 10 thuốc nghi ngờ được báo cáo nhiều nhất |
|||
|
STT |
Hoạt chất |
Số lượng |
Tỷ lệ (%) |
|
1 |
Cefotaxim |
222 |
11,17 |
|
2 |
Streptomycin |
172 |
8,66 |
|
3 |
Ceftriaxon |
108 |
5,44 |
|
4 |
Diclofenac |
104 |
5,23 |
|
5 |
Ceftazidim |
81 |
4,08 |
|
6 |
Paracetamol |
73 |
3,67 |
|
7 |
Primaquin |
73 |
3,67 |
|
8 |
Ciprofloxacin |
62 |
3,12 |
|
9 |
Pyrazinamid |
56 |
2,82 |
|
10 |
Rifampicin |
54 |
2,72 |
4. Các trường hợp báo cáo khẩn
Trong 6 tháng đầu năm 2013, Trung tâm DI & ADR Quốc gia đã giải quyết 31 trường hợp khẩn (quí I: 10 trường hợp, quí II: 21 trường hợp), trong đó có 19 trường hợp báo cáo khẩn và 12 trường hợp công văn phản hồi cho cơ quan quản lý của Bộ Y tế. Như vậy, từ đầu năm 2013 đến nay có tất cả 21 báo cáo tử vong đã được xử lý khẩn theo quy trình của Trung tâm. Trong đó, 9 báo cáo tử vong trên bệnh nhi sử dụng vắc xin Quinvaxem, 3 báo cáo tử vong do sốc phản vệ liên quan đến ceftazidim và 2 báo cáo tử vong do sốc phản vệ liên quan đến cefotaxim. Các trường hợp khẩn đã xử lý trong quí II được tổng hợp trong bảng 3 và bảng 4.
|
Bảng 3: Các trường hợp báo cáo khẩn |
|||||
|
STT |
Mã báo cáo |
Thuốc nghi ngờ Biệt dược (hoạt chất) |
Biểu hiện ADR |
Mối liên quan giữa thuốc và ADR |
Kết quả sau khi xử trí ADR |
|
1 |
VNMC13030053 |
Quinvaxem (vắc xin 5 trong 1) |
Sốt, nôn, bú yếu, khóc thét, môi khô tím, mắt trợn trừng, thái dương có quầng thâm đỏ |
Có thể |
Tử vong |
|
2 |
VNMN13030970 VNMN13030971 VNMN13030972 VNMN13030973 VNMN13030974 VNMN13030975 |
Hexabrix (ioxaglat) |
Chóng mặt, buồn nôn, nôn, kích thích, co giật |
Có khả năng |
Hồi phục không có di chứng |
|
3 |
VNMM13031036 |
Cefotaxon (cefotaxim) |
Sốc phản vệ |
Có khả năng |
Tử vong |
|
4 |
VNMC13030062 |
Quinvaxem (vắc xin 5 trong 1) Euquimol (paracetamol, euquinin, clorpheniramin) |
Mệt, lạnh run, sốt |
Có khả năng |
Hồi phục không có di chứng |
|
5 |
VNMS13041077 |
Quamatel (famotidin) |
Sốc phản vệ |
Chắc chắn |
Tử vong |
|
6 |
VNMC13040067 |
Quinvaxem (vắc xin 5 trong 1) |
Nhiễm khuẩn huyết |
Không chắc chắn |
Tử vong |
|
7 |
VNMM13051547 |
Aminopex (amino acid) |
Sốc phản vệ |
Chắc chắn |
Tử vong |
|
8 |
VNMN13051499 |
Cekadym (ceftazidim) |
Sốc phản vệ |
Chắc chắn |
Tử vong |
|
9 |
VNMS13041086 VNMS13041089 VNMS13041189 |
Cefotaxim ACS Dobfar (cefotaxim) |
Mày đay, mẩn ngứa |
Có khả năng |
Hồi phục không có di chứng |
|
10 |
VNMS13051564 |
Medotaxim (cefotaxim) |
Sốc phản vệ |
Có khả năng |
Tử vong |
|
11 |
VNMM13051470 |
Bicefzidim (ceftazidim) |
Sốc phản vệ |
Có thể |
Tử vong |
|
Bảng 4: Các trường hợp công văn khẩn gửi cơ quan quản lý của Bộ Y tế |
||
|
STT |
Nội dung công văn |
Ngày thực hiện |
|
1 |
Cập nhật thông tin về độ an toàn của domperidon |
25/3/2013 |
|
2 |
Cung cấp thông tin về thuốc chứa cilostazol |
2/4/2013 |
|
3 |
Cập nhật thông tin liên quan đến chỉ định của glucosamin |
12/4/2013 |
|
4 |
Cập nhật thông tin liên quan đến chỉ định của misoprostol |
26/4/2013 |
|
5 |
Cung cấp thông tin về thuốc chứa strontium ranelat |
13/5/2013 |
|
6 |
Cung cấp thông tin về thuốc chứa cyproteron acetat |
5/6/2013 |
II. BÁO CÁO ADR TỪ CÁC ĐƠN VỊ SẢN XUẤT, KINH DOANH DƯỢC PHẨM
Trong 6 tháng đầu năm 2013, Trung tâm DI & ADR Quốc gia và Trung tâm DI & ADR khu vực thành phố Hồ Chí Minh đã ghi nhận 104 báo cáo ADR nghiêm trọng xảy ra trên lãnh thổ Việt Nam từ 15 đơn vị sản xuất và kinh doanh dược phẩm. Trong đó, có 92 báo cáo ADR liên quan đến các chế phẩm đang được lưu hành trên thị trường và 12 báo cáo ADR xảy ra trên bệnh nhân trong quy trình thử nghiệm lâm sàng thuốc mới tại Việt Nam.
Các chế phẩm đang được lưu hành trên thị trường được báo cáo nhiều nhất là: vắc xin Quinvaxem (19 báo cáo), imatinib (18 báo cáo), iopromid (6 báo cáo), rituximab (3 báo cáo), sorafenib (3 báo cáo). Các thuốc nghi ngờ liên quan đến các trường hợp tử vong bao gồmvắc xin Quinvaxem (14 báo cáo), imatinib (4 báo cáo), vắc xin bại liệt (3 báo cáo), cyclosporin (2 báo cáo), bisoprolol (1 báo cáo), cefuroxim (1 báo cáo), hydroxycarbamid (1 báo cáo), mycophenolat mofetil (1 báo cáo), sevofluran (1 báo cáo), vắc xin phòng ung thư cổ tử cung HPV typ 16 và 18 (1 báo cáo).
III. KẾT LUẬN
Trong 6 tháng đầu năm 2013, Trung tâm DI & ADR Quốc gia đã tiếp nhận 2108 báo cáo. Trong đó, 1987 báo cáo được gửi từ các cơ sở khám chữa bệnh, 104 báo cáo được gửi từ các đơn vị sản xuất, kinh doanh dược phẩm và 17 báo cáo từ hoạt động TSR. Các đơn vị tham gia gửi báo cáo gồm 301 cơ sở khám, chữa bệnh và 15 đơn vị sản xuất, kinh doanh dược phẩm. Đối tượng thực hiện báo cáo chủ yếu là bác sĩ. Phần lớn báo cáo được gửi từ các đơn vị ở phía Nam, từ các bệnh viện tuyến tỉnh, bệnh viện đa khoa và bệnh viện thuộc khối công lập. Tổng số phản hồi của Trung tâm DI & ADR Quốc gia liên quan đến báo cáo ADR và các vấn đề về an toàn thuốc đã thực hiện trong 6 tháng đầu năm là 947, tương ứng với 44,9% số báo cáo ADR nhận được. Trong đó, 935 phản hồi cho cán bộ y tế và đơn vị gửi báo cáo và 12 công văn phản hồi cho cơ quan quản lý của Bộ Y tế.
Trung tâm DI & ADR Quốc gia xin trân trọng cảm ơn sự hợp tác của các đơn vị và cán bộ y tế đã tham gia báo cáo ADR và mong tiếp tục nhận được sự phối hợp để triển khai hiệu quả hoạt động báo cáo ADR.

