
Tóm tắt
Nội dung bài
Số lượng báo cáo ADR nhận được đến hết quý I năm 2013 từ các cơ sở khám chữa bệnh là 1022 báo cáo, tăng hơn 2 lần so với quý I năm 2012 (460 báo cáo). Chi tiết số lượng báo cáo nhận được lũy tiến từ tháng 1 đến tháng 3 được trình bày trong hình 1.
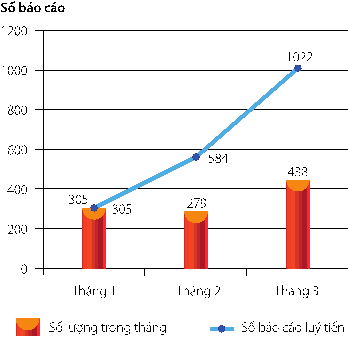
Hình 1: Số lượng báo cáo ADR lũy tiến từ tháng 1 đến tháng 3 năm 2013
2. Tình hình báo cáo ADR từ các đơn vị
Tính đến hết quý I năm 2013, cơ sở khám, chữa bệnh của 55/63 tỉnh, thành phố đã gửi báo cáo ADR. 8 tỉnh chưa gửi báo cáo ADR trong quý I là: Bình Dương, Gia Lai, Kon Tum, Nam Định, Phú Thọ, Phú Yên, Sơn La và Thừa Thiên Huế. Danh sách 10 cơ sở khám chữa bệnh gửi báo cáo nhiều nhất trong tổng số 186 đơn vị đã gửi báo cáo ADR được trình bày trong bảng 1.
|
Bảng 1: Danh sách 10 bệnh viện gửi báo cáo nhiều nhất |
|||
|
STT |
Đơn vị gửi báo cáo |
Tỉnh/thành phố |
Số lượng báo cáo |
|
1 |
Bệnh viện Bạch Mai |
Hà Nội |
154 |
|
2 |
Bệnh viện Phạm Ngọc Thạch |
TP. Hồ Chí Minh |
83 |
|
3 |
Bệnh viện Đa khoa Tỉnh Quảng Ninh |
Quảng Ninh |
46 |
|
4 |
Bệnh viện Hùng Vương |
TP. Hồ Chí Minh |
31 |
|
5 |
Bệnh viện Phụ Sản Hải Phòng |
Hải Phòng |
29 |
|
6 |
Bệnh viện Lao và Phổi Quảng Ninh |
Quảng Ninh |
23 |
|
7 |
Bệnh viện Từ Dũ |
TP. Hồ Chí Minh |
21 |
|
8 |
Bệnh viện Lao và Bệnh Phổi Bắc Giang |
Bắc Giang |
18 |
|
9 |
Bệnh viện Phụ Sản Trung Ương |
Hà Nội |
18 |
|
10 |
Bệnh viện Nhân Dân Gia Định |
TP. Hồ Chí Minh |
17 |
3. Các thuốc nghi ngờ gây ra ADR được báo cáo nhiều nhất
Tổng số 1266 thuốc nghi ngờ được báo cáo trong tổng số 1022 báo cáo ADR (chiếm tỷ lệ 1,24 thuốc/1 báo cáo). Trong đó, các thuốc nghi ngờ gây biến cố bất lợi xuất hiện nhiều nhất thuộc 4 nhóm chính: nhóm thuốc kháng sinh (với 4 đại diện là cefotaxim, ceftriaxon, ceftazidim, levofloxacin), nhóm thuốc điều trị lao (streptomycin, pyrazinamid, rifampicin); nhóm thuốc giảm đau, hạ sốt, chống viêm (paracetamol, diclofenac) và thuốc điều trị sốt rét (primaquin); streptomycin là thuốc được báo cáo nhiều nhất (11,6%) (bảng 2).
|
Bảng 2: Danh sách 10 thuốc nghi ngờ được báo cáo nhiều nhất |
|||
|
STT |
Hoạt chất |
Số lượng |
Tỷ lệ (%) |
|
1 |
Streptomycin |
119 |
11,6 |
|
2 |
Cefotaxim |
107 |
10,5 |
|
3 |
Ceftriaxon |
62 |
6,1 |
|
4 |
Ceftazidim |
49 |
4,8 |
|
5 |
Diclofenac |
43 |
4,2 |
|
6 |
Paracetamol |
42 |
4,1 |
|
7 |
Primaquin |
41 |
4,0 |
|
8 |
Rifampicin |
36 |
3,5 |
|
9 |
Levofloxacin |
35 |
3,4 |
|
10 |
Pyrazinamid |
33 |
3,2 |
4. Các trường hợp báo cáo khẩn
Trong quý I năm 2013, Trung tâm DI & ADR Quốc gia đã giải quyết 10 trường hợp khẩn, trong đó có 4 trường hợp báo cáo khẩn và 6 trường hợp cung cấp thông tin cho Cục Quản lý Dược (bảng 3). Có tất cả 8 báo cáo tử vong đã được ghi nhận, trong đó 7 báo cáo tử vong trên bệnh nhi sử dụng vắc xin Quinvaxem. Trung tâm DI & ADR Quốc gia cũng tiếp tục ghi nhận được chuỗi báo cáo liên quan đến albumin (biệt dược Relab). Các phản ứng có hại liên quan đến vắc xin Quinvaxem và albumin (biệt dược Relab) sẽ được Trung tâm DI & ADR Quốc gia tiếp tục theo dõi và thông báo tới cán bộ y tế. Song song với công tác phản hồi khẩn cho cán bộ y tế và đơn vị gửi báo cáo ADR, Trung tâm DI & ADR Quốc gia cũng liên tục cập nhật thông tin về an toàn thuốc và kịp thời thông báo cho các cơ quan quản lý của Bộ Y tế (6 công văn, bảng 4).
|
Bảng 3: Các trường hợp báo cáo khẩn |
|||||
|
STT |
Mã báo cáo |
Thuốc nghi ngờ |
Biểu hiện ADR |
Mối liên quan giữa thuốc và ADR |
Kết quả sau khi xử trí ADR |
|
1 |
VNMC13010004 VNMC13010005 VNMC13010006 VNMC13010007 VNMC13010008 |
Quinvaxem (vắc xin 5 trong 1) |
Sốt, nôn, bú yếu, khóc thét, môi khô tím, mắt trợn trừng, thái dương có quầng thâm đỏ |
Có thể |
Tử vong |
|
2 |
VNMC13010018 VNMC13010020 |
Quinvaxem (vắc xin 5 trong 1) |
Sốt cao, tím tái, lả đi |
Có thể |
Tử vong |
|
3 |
VNMS13010314 |
Midazolam, propofol, suxamethonium |
Tăng áp lực đường thở, SpO2 tụt, tím tái, ngừng tim, ngừng thở |
Có thể |
Tử vong |
|
4 |
VNMS13010228 VNMS13010229 VNMS13010230 VNMS13010231 |
Relab 20% (albumin) |
Mệt, lạnh run, sốt |
Có khả năng |
Hồi phục không để lại di chứng |
|
Bảng 4: Các trường hợp công văn về an toàn thuốc gửi cơ quan quản lý của Bộ Y tế |
||
|
STT |
Nội dung công văn |
Ngày thực hiện |
|
1 |
Cung cấp thông tin về chỉ định, liều dùng, cách dùng của các thuốc chứa thành phần arginin không phải dạng muối hydroclorid và các thuốc phối hợp arginin hydroclorid với các vitamin |
17/12/2012 |
|
2 |
Chuỗi báo cáo phản ứng có hại liên quan đến thuốc Relab 20% (albumin) |
14/1/2013 |
|
3 |
Thông báo của Cơ quan Quản lý Dược phẩm và Sản phẩm y tế Quốc gia Pháp |
22/1/2013 |
|
4 |
Cung cấp thông tin về độ an toàn của dabigatran etexilat |
30/1/2013 |
|
5 |
Cung cấp thông tin về độ an toàn của cyproteron acetat |
1/2/2013 |
|
6 |
Cung cấp thông tin về độ an toàn của metoclopramid |
11/3/2013 |
II. BÁO CÁO ADR TỪ CÁC ĐƠN VỊ SẢN XUẤT VÀ KINH DOANH DƯỢC PHẨM
Trong quý I năm 2013, Trung tâm DI & ADR Quốc gia và Trung tâm DI & ADR khu vực thành phố Hồ Chí Minh đã nhận được 57 báo cáo ADR nghiêm trọng xảy ra trên lãnh thổ Việt Nam với 16 trường hợp tử vong được gửi từ 11 đơn vị sản xuất, kinh doanh dược phẩm. Trong đó, 49 báo cáo ADR liên quan đến các chế phẩm đang được lưu hành trên thị trường và 8 báo cáo ADR xảy ra trên bệnh nhân trong thử nghiệm lâm sàng.
Các chế phẩm đang được lưu hành trên thị trường được báo cáo nhiều nhất là: vắc xin Quinvaxem (15 báo cáo), imatinib (11 báo cáo), iopromid (4 báo cáo). Các thuốc nghi ngờ liên quan đến các trường hợp tử vong bao gồm vắc xin Quinvaxem (11 báo cáo), imatinib (3 báo cáo), vắc xin bại liệt (3 báo cáo), cyclosporin (2 báo cáo), hydroxycarbamid (1 báo cáo), mycophenolat mofetil (1 báo cáo).
III. KẾT LUẬN
Trong quý I năm 2013, Trung tâm DI & ADR Quốc gia đã tiếp nhận 1079 báo cáo ADR từ 186 cơ sở khám, chữa bệnh và 11 đơn vị sản xuất, kinh doanh dược phẩm. Đối tượng thực hiện báo cáo chủ yếu là bác sĩ, phần lớn báo cáo được gửi từ các đơn vị ở phía Nam, các bệnh viện tuyến tỉnh, bệnh viện đa khoa và bệnh viện thuộc khối công lập.
Trung tâm DI & ADR Quốc gia trân trọng cảm ơn sự hợp tác các đơn vị và cán bộ y tế đã tham gia báo cáo ADR và mong tiếp tục nhận được sự phối hợp để triển khai hiệu quả hoạt động báo cáo ADR.

